高温下,炼铁高炉中存在下列平衡:
回答下列问题:
(1)写出该反应的平衡常数表达式_______________________________________。
(2)升高温度,该反应的平衡常数K值将__________(填“增大”、“减小”、“不变”),平衡体系中固体的质量将__________(填“增大”、“减小”、“不变”)。
(3)已知11OO℃时该反应的平衡常数K=0.263。在1100℃时,测得高炉中。 此时该的化学反应速度是v(正)___________(填“>”、“<”、“=”)v(逆),原因是_________________________________________________________________________。
此时该的化学反应速度是v(正)___________(填“>”、“<”、“=”)v(逆),原因是_________________________________________________________________________。
(4)保持高炉温度为1100℃,向高炉中补充大量的空气,重新达到平衡后,该反应的平衡常数K值 __________(填”>”、“<”、“=”)0.263。
可逆反应 ,在一定条件下达到平衡,若改 变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
,在一定条件下达到平衡,若改 变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
(1)升高温度,B转化率___________,v(正) ___________,v(逆)___________。
(2)使用催化剂,A的物质的量___________,若v(正)增大,则v(逆)____________。
(3)保持温度和压强不变加入稀有气体,则C的物质的量___________,A的转化率___________。
(4)保持温度和体积不变加入稀有气体,则A的转化率___________,v(正)_____________。
(5)若温度和体积不变,反应从正反应开始至平衡,在这个变化过程中,容器内气体的密度___________,压强___________。
(12分)N2(g)+3H2(g)  2NH3(g)反应过程的能量变化如下图所示。
2NH3(g)反应过程的能量变化如下图所示。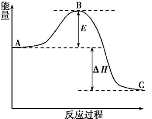
已知生成1 mol NH3(g)的ΔH=-46 kJ·mol-1。请回答下列问题:
(1)图中A、C分别表示 、 ;若该反应使用催化剂,会使图中B点升高还是降低? 。
(2)图中ΔH= kJ·mol-1。
(3)已知恒容时,该体系中各物质浓度随时间变化的曲线如图所示。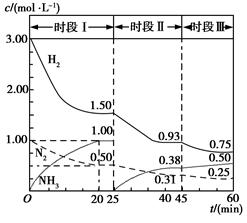
①在0.5 L容器中发生反应,前20 min内,v(NH3)=________,放出的热量为________。
②45 min时采取的措施是_______________________。
③比较I、II、III时段的化学平衡常数(分别用K1、K2、K3表示)大小________。
(12分)在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)  2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
(1)该温度下,若温度升高,K值将________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是________点。从起点开始首次达到平衡时,以NO2表示的反应速率为____________。
(3)25 min时,加入了__________(填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度________(填“大于”、“小于”或“等于”)0.8 mol·L-1,理由是_______________________________________________________________________。
在一定温度下,将2molA和2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g)+B(g)  xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于________________(2)A的转化率为_________________
(3)生成D的反应速率为_________________
(4)如果增大反应体系的压强,则平衡体系中C的质量分数_________
(5)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各 mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入________物质_________mol
mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入________物质_________mol
密闭容器中mA(g)+nB(g)  pC(g),反应达到平衡,经测定增大压强P时,
pC(g),反应达到平衡,经测定增大压强P时,
A的转化率随P而变化的曲线如图。
则:(1)增大压强:A的转化率 ,平衡向 移动,达到平衡后,混合物中C的质量分数_____ 。
(2)上述化学方程式中的系数m、n、p的正确关系是 。
(3)降低温度,C的质量分数增大,则:平衡向 移动,A的转化率 ,正反应是 热反应。(以上各空用适当的化学用语或关系式填写)
( 10分)在密闭容器中进行下列反应:CO2(g)+C(s)  2CO(g) ΔH>0,起始通入2molCO,达到平衡后,改变下列条件,则指定物质的浓度、百分含量(填“不变”“增大”“减小”)及平衡如何变化(填“正移”“逆移”“不移动”):
2CO(g) ΔH>0,起始通入2molCO,达到平衡后,改变下列条件,则指定物质的浓度、百分含量(填“不变”“增大”“减小”)及平衡如何变化(填“正移”“逆移”“不移动”):
(1)增加C,平衡________,c(CO)________。
(2)减小密闭容器的体积,保持温度不变,则平衡______________,c(CO2)___ _____。
(3)通入N2,保持密闭容器的体积和温度不变,则平衡________,c(CO2)________。
(4)保持密闭容器的体积不变,升高温度,则平衡__________________,c(CO)________
(5)恒压通入N2,CO2的百分含量
(6)恒压再通入2molCO,CO2的百分含量
二甲醚(CH3OCH3)被称为21世纪界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1
②2CH3OH(g) CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g) +H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)若要增大反应①中H2的转化率,在其它条件不变的情况下可以采取的措施为 。
| A.加入某物质作催化剂 | B.加入一定量CO |
| C.反应温度降低 | D.增大容器体积 |
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2 mol/L,5 min后达到平衡,CO的转化率为50%,则5 min内CO的平均反应速率为 ;
若反应物的起始浓度分别为:c(CO)=4 mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2 mol/L,
a= mol/L。
(3)催化反应室中总反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的△H = 。
CH3OCH3(g)+CO2(g)的△H = 。
在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物 质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为________。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是____________________________。
②列式计算温度T时反应的平衡常数K2:_________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是_________________________________________________________。
(本题8分)对于反应xA(g)+yB(g) pC(g)+qD(g)压强与温度对C的质量分数的影响如图:
pC(g)+qD(g)压强与温度对C的质量分数的影响如图:
(1)若m、n表示不同温度,则m n,正反应为 反应(填“放热”、“吸热”);
(2)若m、n表示不同压强,则m n,(x+y) (p+q)(填<、>、=);
(3)b曲线的OG段比a曲线的OH段陡的原是: ;
(4)a曲线的HE段高于b曲线的GF段的原是: 。
(8分)某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:
(1)该反应的化学方程式为____________________________________。
(2)反应开始至4 min时,A的平均反应速率为____________________________。
(3)4 min时,反应是否达到平衡状态?________(填“是”或“否”), 8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
有一化学反应2A B+D ,B、D起始浓度为0,在四种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
B+D ,B、D起始浓度为0,在四种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
| 实验 序号 |
浓度(mol/L) |
时间(min) |
|||||||
| 0 |
10 |
20 |
30 |
40 |
50 |
60 |
|||
| 1 |
温度 |
800 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800 ℃ |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
| 3 |
800 ℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
(1)在实验1,反应在0至40分钟时间内A的平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,可推测实验2中隐含的条件是
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则达到平衡时v3 v1(填>、=、<=,)800℃时,反应平衡常数= ,且C3= mol/L,可推测实验3中隐含的条件是 。
(4)800℃时,反应B+D  2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0,达到平衡时A的浓度为 mol/L, B的转化率= 。
2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0,达到平衡时A的浓度为 mol/L, B的转化率= 。
氨气主要用作致冷剂及制取铵盐和氨肥
(1)某研究小组在673K、30MPa条件下,在体积为VL的密闭容器中进行反应:N2(g)+3H2(g)⇌2NH3(g),其n(H2)和n(NH3)随时间变化的关系如图所示.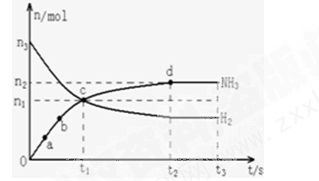
下列叙述正确的是 .
| A.点a的正反应速率比点b的大 |
| B.点c处反应达到化学平衡状态 |
| C.若t3时由673K升至773K,则n(H2)将增大 |
| D.t2、t3时刻,n(N2)不相等 |
(2)在一定温度和催化剂下,将6.4mol H2和2.4molN2混合于一个容积为4L的密闭容器中发生反应,在3min末时反应恰好达平衡,此时生成了1.6mol NH3.①3min内以H2表示的化学反应速率 ;②该条件下的平衡常数
(3)已知:N2(g)+O2(g)=2NO(g)△H= +180.5kJ/mol
N2(g)+3H2(g)⇌2NH3(g)△H= -92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H= -483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:
在一定体积的密闭容器中,进行如下化学反应:
C(s)+H2O(g)  CO(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
| t/(℃) |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.7 |
0.8 |
1.0 |
1.6 |
2.4 |
(1)该反应的化学平衡常数表达式为K=____ ____,该反应为________反应(填“吸热”或“放热”)。
(2)能作为判断反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.c(H20)不变
C.v正(H2)=v逆(H2O) D.c(H2)=c(CO)
(3)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,缩小容器的体积,平衡________移动(填“正向”、“逆向”或“不”)。H2O(g)的浓度___ ____,CO(g)的浓度___ ____(填“变大”、“不变”或“变小”)
中国环境监测总站数据显示,颗粒物(PM2.5)是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx 等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5 样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断PM2.5 的酸碱性,试样的pH=______。
(2)碘循环工艺不仅能吸收SO2 降低环境污染,同时又能制得氢气,具体流程如下:
①用离子方程式表示反应器中发生的反应:__________________________。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是_________________________。