一定条件下,在体积为3 L的密闭容器中反应CO(g)+ 2H2(g) CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
(1)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用含图中字母的代数式表示)。
(2)判断该可逆反应达到化学平衡状态的标志是__________(填字母)。
A.v消耗(CH3OH)=" 2" v消耗(H2) B.CO、H2、CH3OH的浓度均不再变化
C.混合气体的平均相对分子质量不再改变 D.混合气体的密度不再改变
(3)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是________(填字母)。
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加 D.重新平衡时c(H2)/ c(CH3OH)减小
某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H =-49.0 kJ·mol-1 测得CH3OH的物质的量随时间变化如图所示,回答问题:
CH3OH(g)+H2O(g) △H =-49.0 kJ·mol-1 测得CH3OH的物质的量随时间变化如图所示,回答问题:
①该反应的平衡常数表达式为K= 。
②曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“大于”、“等于”或“小于”)。
③其它条件不变时,下列措施能提高H2转化率的是 (填字母)。
| A.减小CO2的浓度 | B.降低温度 | C.增加H2的浓度 | D.增大压强 |
红磷P(s)和Cl2(g)发生反应,生成PCl3(g)和PCl5(g)。反应过程和能量的关系如图所示(图中△H表示生成1 mol 产物的数据)。
根据图回答下列问题:
(1)P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式:
(2)PCl5(g)分解生成PCl3(g)和Cl2(g)的热化学方程式:____________________;
(3)上述分解反应是一个可逆反应。温度T1时,在体积为1L的密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60mol,其分解率α1等于 ,平衡常数K1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,平衡常数为K2,则α2 α1,
K2 K1。(填“大于”、“小于”或“等于”)
(4)P和Cl2分两步反应生成1mol PCl5的△H3 =
硫酸工业中接触氧化是最重要的一个反应:2SO2(g) + O2(g)  2SO3(g) △H= -197kJ/mol。为了研究这一反应,在体积为2L的密闭容积中,投入2mol SO2,1molO2,然后控制反应温度,在反应进行至20min时加入一定的催化剂,测定并记录一定时间内容器内SO3的物质的量,得到下表:
2SO3(g) △H= -197kJ/mol。为了研究这一反应,在体积为2L的密闭容积中,投入2mol SO2,1molO2,然后控制反应温度,在反应进行至20min时加入一定的催化剂,测定并记录一定时间内容器内SO3的物质的量,得到下表:
| 时间/min |
10 |
20 |
30 |
40 |
50 |
| N(SO3)/mol |
0.4 |
0.6 |
1.2 |
1.6 |
1.6 |
(1)反应前10 min,用O2表示该反应的反应速率v(O2)= 。
(2)该温度下,该反应的平衡常数为 。
(3)在反应进行至50min时,再向容器中充入2molSO2和1molO2,达到新平衡后,SO2的转化率将 。(填“增大”、“减小”或“不变”)
(4)保持温度不变,若在该容器中只投入2mol SO3,达到平衡时,反应吸收的热量为 kJ。
I.下列有关实验操作或结果的说法中正确的是
A.滴定时,眼睛应始终注视滴定管内液面的变化
B.测定酸碱滴定曲线:开始时测试和记录的间隔可稍小些,滴定至终点附近则要大些
C.酸碱中和滴定之前,锥形瓶用蒸馏水洗净即可,不能用待测液润洗
D.滴定管经蒸馏水洗净后,直接注入标准液,将使测得的待测液浓度偏低
E.用pH试纸测量某溶液的pH时要先将试纸润湿度不变的某容器分隔成A、B两部分,A容器容积固定不变,B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2 molSO3 和1molN2,在相同条件下发生可逆反应:2SO2(g)+O2(g)  2SO3(g),填空:
2SO3(g),填空:
F.用广泛pH试纸测量H2SO4溶液的pH时,测得pH=3.2
II.如图所示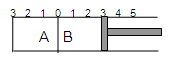
(1)固定活塞位置在3处不动,达到平衡后,设A中压强为P1,B中压强为P2,则P1与P2的大小是:P1 P2 (填“<”、“>”、“=”)。
(2)若要使A中与B中平衡状态相同,可移动活塞的位置应在 处。
(3) 若活塞右移到5处,达到平衡后,B中SO3为x mol,A中SO3为y mol,则x y(填“<”、“>”、“=”),理由是 。
某温度下在容积固定的密闭容器中,下列反应达到平衡:
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
| 初始投料比n(CO):n(H2O) |
CO转化率 |
H2O转化率 |
| 1:1 |
0.5 |
0.5 |
| 1:2 |
0.67 |
0.335 |
| 1:3 |
0.75 |
0.25 |
(1)已知CO和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l)△H= -44kJ/mol,写出CO(g)和H2O(g)反应的热化学方程式 。
(2)该反应的平衡常数为 。该温度下,向该容器中充入1mol CO、3molH2O(g)、2mol CO2、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
(3)结合表中数据判断下列说法中正确的是 。
A.增加H2O(g)的量,CO的转化率升高而H2O(g)的转化率降低
B.若CO与H2O(g)的转化率相同,则二者的初始投入量一定相同
C.CO和H2O(g)初始物质的量之比等于二者转化率之比
D.当CO与H2O(g)物质的量之比为1:4时,CO的转化率为0.85
(15分) 碳及其化合物有广泛的用途。
(1)反应C(s)+ H2O(g) CO(g) +H2 (g) ΔH=" +131.3" kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
CO(g) +H2 (g) ΔH=" +131.3" kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
| A.增加碳的用量 | B.升高温度 | C.用CO吸收剂除去CO | D.加入催化剂 |
(2)已知,C(s)+ CO2(g) 2CO(g) △H=+172.5kJ•mol-1
2CO(g) △H=+172.5kJ•mol-1
则反应 CO(g)+H2O(g) CO2(g)+H2(g) 的△H= kJ•mol-1。
CO2(g)+H2(g) 的△H= kJ•mol-1。
(3)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
| t / min |
2 |
4 |
7 |
9 |
| n(H2O)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
① 其它条件不变,降低温度,达到新平衡前v(逆)_____v(正)(填“>”、“<”或“="”)" 。
②该温度下,此反应的平衡常数K=______ _____;(写计算过程)
Ⅰ.在一定条件下,xA+yB  zC,达到平衡,试填写下列空白:
zC,达到平衡,试填写下列空白:
(1)已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向___ ___移动。
(2)若B、C是气体,其他条件不变时增加A的用量,平衡不移动,则A的状态为___ ___。
Ⅱ.已知NO2和N2O4可以相互转化:
2NO2(g)  N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
(1)图中共有两条曲线X和Y,其中曲线_______表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是__________。
(2)①前10 min内用NO2表示的化学反应速率v(NO2)=_______mol·L-1·min-1。
②0~15 min ,反应2NO2(g)  N2O4(g)的平衡常数Kb=_______。
N2O4(g)的平衡常数Kb=_______。
③25 min~35 min时,反应2NO2(g)  N2O4(g)的平衡常数Kd_____Kb(填“>”、 “=”或“<”)。
N2O4(g)的平衡常数Kd_____Kb(填“>”、 “=”或“<”)。
(3)反应25 min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是___________________(用文字表达),若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施是_________。
A.加入催化剂 B.缩小容器体积 C.升高温度 D.加入一定量的N2O4
近年来北京市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。 (1)汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K= 。(计算结果保留小数点后两位数字)
(1)汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K= 。(计算结果保留小数点后两位数字)
(2)一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如图所示。(已知: )
)
 ①反应2NO(g) N2(g)+O2(g)为(填“吸热”或“放热) 反应。
①反应2NO(g) N2(g)+O2(g)为(填“吸热”或“放热) 反应。 ②一定温度下,能够说明反应2NO(g) N2(g)+O2(g)已达到平衡的是(填序号) 。
②一定温度下,能够说明反应2NO(g) N2(g)+O2(g)已达到平衡的是(填序号) 。
a.容器内的压强不发生变化
b.NO、N2、O2的浓度保持不变
c.NO分解的速率和NO生成的速率相等
d.单位时间内分解4mol NO,同时生成2 mol N2
(3)①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NO2消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)=CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) △H3=-867kJ·mol-1
△H2= .
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为 。
合成氨工业的核心反应是:N2(g)+3H2(g)  2NH3(g) ΔH="Q" kJ·mol-1,能量变化如图所示,回答下列问题:
2NH3(g) ΔH="Q" kJ·mol-1,能量变化如图所示,回答下列问题:
(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是: E1_________(填“增大”、“减小”、“不变”)
(2)在500 ℃、2×107 Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量_______ 46.2 kJ(填“<”、“>”或“=”)
(3)关于该反应的下列说法中,正确的是_________。
A.ΔH>0,气体分子数目增多 B.ΔH>0,气体分子数目减少
C.ΔH<0,气体分子数目增多 D.ΔH<0,气体分子数目减少
(4)将一定量的N2(g)和H2(g)放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol。计算该条件下达到平衡时H2转化为NH3的转化率_________。若升高温度,K值变化_______(填“增大”、“减小”或“不变”)。
(5)在上述(4)反应条件的密闭容器中欲提高合成氨中H2的转化率,下列措施可行的__(填字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入惰性气体
C.改变反应的催化剂 D.分离出氨气
某温度时,在10 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化下表中数据
| t/min |
X/mol |
Y/mol |
Z/mol |
| 0 |
1.00 |
2.00 |
0.00 |
| 1 |
0.90 |
1.80 |
0.20 |
| 3 |
0.75 |
1.50 |
0.50 |
| 5 |
0.65 |
1.30 |
0.70 |
| 9 |
0.55 |
1.10 |
0.90 |
| 10 |
0.55 |
1.10 |
0.90 |
| 14 |
0.55 |
1.10 |
0.90 |
(1) 体系中发生反应的化学方程式是____________;
(2) 计算该反应在0~3 min时间内产物Z的平均反应速率:________;
(3) 该反应达到平衡时反应物X的转化率α等于________;
(4) 如果该反应是放热反应,改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1所对应的实验条件改变是:______ ___ ___。
(5)如果起始加入X、Y、Z的物质的量分别为2.00 mol、4.00 mol和0 mol,在原温度下达平衡时,X的转化率为α!,则α! α(填 < > =)。
(6)如果在原温度下起始加入X、Y、Z的物质的量分别为1.00 mol、1.00 mol和1.00 mol,此时可逆反应的反应速率:u(正) u(逆)(填 < > =)。
在一密闭容器中发生反应N2+3H2 2NH3 , ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
2NH3 , ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
回答下列问题:
(1)处于平衡状态的时间段是__________(填选项)。
A t0~t1 B t1~t2 C.t2~t3
D.t3~t4 E.t4~t5 F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是(填选项),t1时刻________; t4时刻________。
A 增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是__________(填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为__________。
现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1) m+n_________p(填“>”“=”“<”)。
(2)若加压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入A(体积不变),则B的转化率_________。
(4)若降低温度,则平衡时B、C的浓度之比 将_________。
将_________。
(5)若加入催化剂,平衡时气体混合物的总物质的量____ _____。
(6)若B是有色物质,A、C均无色,维持容器内压强不变,充入氖气时,混合物颜色____ (填“变深”“变浅”或“不变”)。
(1) 由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式: _ 。
若1g水蒸气转化成液态水放热2.444kJ,则氢气的燃烧热为_____________。
(2)已知①CO(g) + 1/2 O2(g) = CO2(g) ; ΔH1= -283.0 kJ/mol
②H2(g) + 1/2 O2(g) = H2O(l) ; ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3H2O(l); ΔH3="-1370" kJ/mol
试写出一氧化碳与氢气反应生成液态水和乙醇液体的热化学方程式:
___________________________________________________________。
(3)Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K,测得在不同
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K,测得在不同
温度下,K值如下:
| 温度/℃ |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2.40 |
①若500℃时进行反应,CO2起始浓度为2 mol·L-1,CO的平衡浓度为________。
②此反应焓变中的a________0(填大于、小于、等于)。
现有反应:mA(g)+nB(g)  pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为________热反应,且m+n________p(填“>”“=”或“<”)。
(2)减压时,A的质量分数__________。(填“增大”“减小”或“不变”,下同)
(3)若容积不变加入B,则A的转化率__________,B的转化率__________。
(4)若升高温度,则平衡时B、C的浓度之比c(B)/c(C)将__________。
(5)若加入催化剂,平衡时气体混合物的总物质的量_____________________。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色__________;而维持容器内压强不变,充入氖气时,混合物颜色__________(填“变深”“变浅”或“不变”)。