在一密闭容器中进行如下反应:3H2(气)+N2(气) 2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
| A.H2为 0.6mol/L、N2为 0. 2mol/L | B.NH3为 0.25mol/L |
| C.N2、NH3均为 0.15mol/L | D.NH3为 0.4mol/L |
对于化学反应的限度的叙述不正确的是( )
| A.任何可逆反应都有一定的限度 |
B.对于反应2SO2(g)+O2(g) 2SO3(g)只有达到限度时才有2v(O2)=v(SO3) 2SO3(g)只有达到限度时才有2v(O2)=v(SO3) |
C.对于反应2SO2(g)+O2(g) 2SO3(g)达到限度时,增大容器容积能减小正反应速率 2SO3(g)达到限度时,增大容器容积能减小正反应速率 |
| D.化学反应达到限度时,正逆反应速率相等 |
可逆反应2SO2 (g)+ O2 (g) 2SO3(g)达到平衡的标志是
2SO3(g)达到平衡的标志是
① 消耗2 mol SO2的同时生成2 mol SO3
②SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
| A.①② | B.①③ | C.只有③ | D.只有① |
如图表示可逆反应:N2(g)+3H2(g)═2NH3(g)达到化学平衡状态时外界条件影响导致平衡移动的曲线,根据判断影响平衡移动的因素是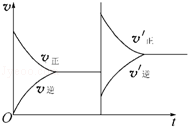
| A.升高温度,同时加压 |
| B.减小压强,同时降温 |
| C.增大反应物的浓度,使用催化剂 |
| D.增大反应物的浓度,同时减小生成物的浓度 |
在恒容密闭容器中,NH3和NO在一定条件下发生如下反应:
2NH3(g) + NO(g) 2N2(g) + 3H2O(g) ΔH<0 下列有关说法正确的是( )
2N2(g) + 3H2O(g) ΔH<0 下列有关说法正确的是( )
| A.其它条件不变时,使用高效催化剂,不可以使NO的转化率增大 |
| B.平衡时,其它条件不变,充入NH3,平衡向右移动,NH3的转化率增大 |
| C.当混合气体的密度不变了,则反应达到化学平衡状态 |
| D.平衡时,其它条件不变,升高温度可使该反应的平衡常数增大 |
在容积不变的密闭容器中,一定条件下发生反应:2A(?) B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是( )
B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是( )
| A.若正反应是吸热反应,则A为非气态 |
| B.若正反应是放热反应,则A为非气态 |
| C.在平衡体系中加入少量C,该平衡向逆反应方向移动 |
| D.改变压强对该平衡的移动一定无影响 |
对于反应2CO(g)+ O2(g) 2CO2(g)(ΔH<0),在一定条件下建立化学平衡后,下列各条件变化时,能使平衡向正方向移动的是
2CO2(g)(ΔH<0),在一定条件下建立化学平衡后,下列各条件变化时,能使平衡向正方向移动的是
| A.恒容通入少量He | B.恒容通入少量CO2 |
| C.升高温度 | D.缩小容器体积 |
下列事实中,能用勒夏特列原理解释的是
| A.配制FeSO4溶液时,加入一些铁粉 |
| B.500℃左右比室温更有利于合成氨的反应 |
| C.实验室常用排饱和食盐水的方法收集氯气 |
| D.由H2、I2(g)、HI组成的平衡体系,加压后颜色加深 |
对于硫酸工业中SO2的催化氧化反应 2SO2+O2 2SO3,下列说法错误的是
2SO3,下列说法错误的是
| A.使用催化剂能加快化学反应速率 |
| B.增大O2浓度可以使SO2转化率达到100% |
| C.降低反应温度,化学反应速率减慢 |
| D.增大O2浓度,化学反应速率增大 |
已知图一表示的是可逆反应CO(g)+H2(g) C(s)+H2O(g)△H>0的化学反应速率与实践的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g)△H>0的化学反应速率与实践的关系,图二表示的是可逆反应2NO2(g) N2O4(g) △H<0的浓度随时间的变化情况。下列说法中正确的是( )
N2O4(g) △H<0的浓度随时间的变化情况。下列说法中正确的是( )
| A.图一t2时改变的条件可能是升高了温度或增大了压强 |
| B.图一t2时改变的条件一定是增大了反应物的浓度 |
| C.图二t1时改变的条件可能是升高了温度或增大了压强 |
| D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |
在某恒容密闭容器中进行如下可逆反应:2M(g)+N(g) W(?)+4Q(g)△H<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是
W(?)+4Q(g)△H<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是
A. |
B. |
C. |
D. |
氯化铁和硫氰化钾在溶液中存在下列平衡:Fe3+(aq)+3SCN-(aq) Fe(SCN)3(aq),某氯化铁和硫氰化钾的混合溶液中,Fe(SCN)3的物质的量浓度与温度T的关系如图所示(曲线上任何一点都表示平衡状态),下列说法不正确的是( )
Fe(SCN)3(aq),某氯化铁和硫氰化钾的混合溶液中,Fe(SCN)3的物质的量浓度与温度T的关系如图所示(曲线上任何一点都表示平衡状态),下列说法不正确的是( )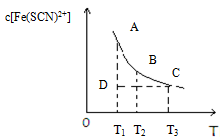
| A.FeCl3(aq)与KSCN(aq)反应的热化学反应方程式为:Fe3+(aq)+SCN-(aq)=Fe(SCN)2+(aq) △H>0 |
| B.温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1<K2 |
| C.反应处于D点时,一定有V正>V逆 |
| D.A点与B点相比,A点的c(Fe3+)大 |
对可逆反应A(g)+2B(g) 3C(g),在其他条件不变的情况下,下列有关叙述不正确的是( )
3C(g),在其他条件不变的情况下,下列有关叙述不正确的是( )
A.单位时间内消耗amol(A),同时消耗3amolC时,反应处于平衡状态
B.增大容器的体积,化学平衡不移动,反应速率也不变
C.升高温度使c(B)增大,可知正反应为放热反应
D.加入催化剂,改变了反应历程,但反应的△H不会变
中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%。用于净化汽车尾气的反应为2NO(g)+2CO(g) 2CO2(g)+N2(g),已知该反应在570K时平衡常数为1×1059,但反应很慢。下列说法正确的是( )

| A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B.提高尾气净化效率的常用方法是升高温度 |
| C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率 |
| D.提高尾气净化效率的最佳途径是使用高效催化剂 |
下列各物质的颜色变化不是由平衡移动引起的是( )
| A.H2、I2、HI平衡混合气体加压颜色变深 |
| B.氯水光照颜色变浅 |
| C.NO2、N2O4混合气体加热颜色变深 |
| D.FeCl3和KSCN的混合溶液中加入FeCl3固体,溶液颜色加深 |