在一个不传热的固定容积的密闭容器中发生可逆反应:mA(g) + nB(g) ⇌pC(g) + qD(g) ,当m、n、p、q为任意整数(不为零)时,不能说明达到平衡状态的标志是
| A.D的质量不再改变 |
| B.各组分的浓度不再改变 |
| C.反应速率υA:υB:υC:υD=m:n:p:q |
| D.单位时间内m mol A断键发生反应,同时p mol C也断键发生反应 |
温度一定时,于密闭容器中发生可逆反应:mA(气)+nB(气)  pC(气),达到平衡后,若将混合气体的体积压缩到原来的
pC(气),达到平衡后,若将混合气体的体积压缩到原来的 ,当再次达到平衡时,C的浓度为原平衡时C的浓度的1.9 倍,则下列叙述中正确的是
,当再次达到平衡时,C的浓度为原平衡时C的浓度的1.9 倍,则下列叙述中正确的是
| A.平衡向逆反应方向移动 | B.C气体的体积分数增大 |
| C.气体A的转化率升高 | D.m+n>p |
已知H2(g)+I2(g)  2HI(g) ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是( )
2HI(g) ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是( )
| A.甲中充入HI气体,乙中不变 | B.甲降低温度,乙增大压强 |
| C.甲中加入0.1 mol He,乙中不变 | D.甲增加0.1 mol H2,乙增加0.1 mol I2 |
深海中存在可燃冰(CH4·nH2O固体)。已知:CH4·nH2O(s) CH4(g)+nH2O(l)-Q(Q>0)深海中能够存在可燃冰,是因为深海具有以下条件中的
CH4(g)+nH2O(l)-Q(Q>0)深海中能够存在可燃冰,是因为深海具有以下条件中的
| A.低温高压 | B.高温低压 | C.低温低压 | D.高温高压 |
下列说法正确的是
| A.室温某酸溶液的pH等于3,则由水电离产生的c(H+)=1×10-11mol/L |
B.对于反应X+3Y2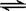 Z,增大压强使平衡向生成Z的方向移动,平衡常数增大 Z,增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| C.自发反应一定是熵增大,非自发反应一定是熵减小或不变 |
| D.某温度下,向AgCl饱和溶液中加入蒸馏水,AgCl的溶解度、Ksp均增大 |
可逆反应在一定条件下达到化学反应限度时,下列说法正确的是
| A.反应停止了 |
| B.正反应速率与逆反应速率均为零 |
| C.反应物和生成物浓度相等 |
| D.正反应速率和逆反应速率相等 |
在容积不变的密闭容器中,一定条件下发生反应:2A ⇌B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是
| A.升高温度,正反应速率增大,逆反应速率减小 |
| B.若正反应是放热反应,则A为气态 |
| C.若向容器中充入惰性气体,则平衡向右移动 |
| D.物质A一定为非气态,且正反应是吸热反应 |
化学与STSE(社会、科学、技术和环境)密切相关,下列说法正确的是
①寻找合适催化剂提高合成氨工业中原料的转化率
②氟氯烃分解产生的氯原子因能降低臭氧分解的活化能而加速臭氧的分解反应
③氟化物防止龋齿所涉及到的化学原理其实就是沉淀的转化
④煤气中毒或救治与氧气、一氧化碳和血红蛋白结合过程中的化学平衡移动有关
| A.①②③ | B.②③④ | C.①④ | D.③④ |
在体积不变的密闭容器中按一定比例通入氮气和氢气,反应合成氨气,该反应放热。欲加快反应的速率同时提高合成氨中H2的转化率,下列措施可行的是( )
| A.升高温度 | B.适当增大压强 | C.加入催化剂 | D.从容器中分离出氨 |
利用催化技术可将汽车尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+2CO 2CO2+N2。某温度下,在容积不变的密闭容器中通入NO和CO,
2CO2+N2。某温度下,在容积不变的密闭容器中通入NO和CO,
测得不同时间的NO和CO的浓度如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO)/×10-3mol·L-1 |
1.00 |
0.45 |
0.25 |
0.15 |
0.10 |
0.10 |
| c(CO)/×10-3mol·L-1 |
3.60 |
3.05 |
2.85 |
2.75 |
2.70 |
2.70 |


 下列说法中,不正确的是
下列说法中,不正确的是 A.2s内的平均反应速率υ(N2)=1.875×10-4mol·L-1·s-1
A.2s内的平均反应速率υ(N2)=1.875×10-4mol·L-1·s-1 B.在该温度下,反应的平衡常数K=5
B.在该温度下,反应的平衡常数K=5 C.若将容积缩小为原来的一半,NO转化率大于90%
C.若将容积缩小为原来的一半,NO转化率大于90% D.使用催化剂可以提高单位时间CO和NO的处理量
D.使用催化剂可以提高单位时间CO和NO的处理量
一定量的混合气体,在密闭容器中发生如下反应:xA(g)+yB(g) zC(g),达到平衡后测得A气体的浓度为1mol·L-1,当恒温下将密闭容器的容积扩大到2倍再达到平衡后,测得A的浓度为0.7mol·L-1,则下列叙述正确的是
zC(g),达到平衡后测得A气体的浓度为1mol·L-1,当恒温下将密闭容器的容积扩大到2倍再达到平衡后,测得A的浓度为0.7mol·L-1,则下列叙述正确的是
| A.平衡向正反应方向移动 | B.x + y = z |
| C.C的体积分数升高 | D.B的转化率降低 |
已知25℃时Ksp[Mg(OH)2]=1.8×10﹣11,Ksp[Fe(OH)3]=8.0×10﹣38,Kb(NH3·H2O)=1.8×10﹣5,下列叙述中不正确的是( )
| A.25℃时,向等浓度的MgCl2和FeCl3混合溶液中逐滴加入氨水,先出现红褐色沉淀 |
| B.25℃时,MgCl2溶液中有少量FeCl3时,可以加入MgO进行除杂 |
| C.25℃时,加大量水稀释氨水,电离程度增大,溶液导电能力增强 |
D.25℃时,NH4++H2O NH3·H2O+H+的平衡常数为5.6×10﹣10 NH3·H2O+H+的平衡常数为5.6×10﹣10 |