已知反应:2NO2(g)+4CO(g) N2(g)+4CO2(g) ΔH<0。将一定量的NO2与CO充入装有催化剂的注射器中后封口。右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法不正确的是
N2(g)+4CO2(g) ΔH<0。将一定量的NO2与CO充入装有催化剂的注射器中后封口。右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法不正确的是
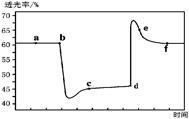
| A.b点的操作是快速压缩注射器 |
| B.c点与a点相比,c(NO2)、c(N2)都增大 |
C.e点: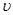 (正) < (正) <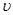 (逆) (逆) |
| D.若考虑体系温度变化,且没有能量损失,则平衡常数K(c) >K(f) |
在两个容积均为1L密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH。CO2的平衡转化率α(CO2)与温度的关系如下图所示。
C2H4(g)+4H2O(g) ΔH。CO2的平衡转化率α(CO2)与温度的关系如下图所示。

下列说法正确的是
| A.该反应的ΔH>0 |
| B.氢碳比:X<2.0 |
| C.在氢碳比为2.0时,Q点v(逆)小于P点的v(逆) |
| D.P点温度下,反应的平衡常数为512 |
PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,并于10 min时达到平衡:PCl3(g)+Cl2(g) PCl5(g) ΔH<0。有关数据如下:
PCl5(g) ΔH<0。有关数据如下:
| |
PCl3(g) |
Cl2(g) |
PCl5(g) |
| 初始浓度/(mol/L) |
2.0 |
1.0 |
0 |
| 平衡浓度/(mol/L) |
c1 |
c2 |
0.4 |
下列判断不正确的是
A.10 min内,v(Cl2)="0.04" mol/(L·min)
B.升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大
C.当容器中Cl2为1.2 mol时,反应达到平衡
D.平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO,MgSO4(s) + CO(g) MgO(s) + CO2(g) +SO2(g) △H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
| 选项 |
x |
y |
| A |
温度 |
容器内混合气体的密度 |
| B |
CO的物质的量 |
CO2与CO的物质的量之比 |
| C |
SO2的浓度 |
平衡常数K |
| D |
MgSO4的质量(忽略体积) |
CO的转化率 |
密闭的真空容器中放入一定量CaO2固体,发生反应2CaO2(s) 2CaO(s)+O2(g)并达到平衡。保持温度不变,缩小容器容积为原来的一半,重新平衡后,下列叙述正确的是
2CaO(s)+O2(g)并达到平衡。保持温度不变,缩小容器容积为原来的一半,重新平衡后,下列叙述正确的是
| A.平衡常数减小 | B.CaO的量减少 | C.氧气浓度变大 | D.CaO2的量不变 |
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/ ℃ |
700 |
800 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005 mol/(L·s)。下列说法正确的是
A.4 s时c(B)为0.76 mol/L
B.830℃达平衡时,A的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.1200℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为0.4
A(g)+B(g)的平衡常数的值为0.4
已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) △H<0。在恒温条件下将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中,反应物浓度随时间变化关系如图。下列说法正确的是
N2O4(g) △H<0。在恒温条件下将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中,反应物浓度随时间变化关系如图。下列说法正确的是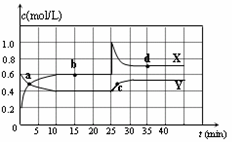
| A.图中Y曲线是表示NO2浓度随时间的变化曲线 |
| B.前10 min内v(N2O4)为0.1 mol/( L·min) |
| C.25 min时,导致平衡移动的原因是将密闭容器的体积缩小为1L |
| D.25 min时,导致平衡移动的原因是向容器通入适量NO2 |
在体积一定的密闭容器中,给定物质A、B、C的量,在一定条件下发生反应,建立如下化学平衡:aA(g)+ bB(g) xC(g),符合图(1)所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图(2)中,Y轴是指
xC(g),符合图(1)所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图(2)中,Y轴是指

A.反应物A的百分含量 B.反应物B的平衡转化率
C.平衡混合气的密度 D.平衡混合气的总物质的量
下列有关平衡常数的说法正确的是
| A.温度越高,K值越大 | B.K值越大,正反应速率越大 |
| C.K值的大小与起始浓度有关 | D.K值越大,反应物的转化率越大 |
相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g) 2SO3(g);△H=-197kJ/mol。实验测得起始、平衡时的有关数据如下表:下列叙述正确的是
2SO3(g);△H=-197kJ/mol。实验测得起始、平衡时的有关数据如下表:下列叙述正确的是
| 器 |
起始各物质的物质的量/mol |
达到平衡时体系能量的变化 |
|||
| SO2 |
O2 |
SO3 |
Ar |
||
| 甲 |
2 |
1 |
0 |
0 |
放出热量:Q1 |
| 乙 |
1.8 |
0.9 |
0.2 |
0 |
放出热量:Q2 |
| 丙 |
1.8 |
0.9 |
0.2 |
0.1 |
放出热量:Q3 |
| 容器 |
起始各物质的物质的量/mol |
达到平衡时体系能量的变化 |
|||
| SO2 |
O2 |
SO3 |
Ar |
||
| 甲 |
2 |
1 |
0 |
0 |
放出热量:Q1 |
| 乙 |
1.8 |
0.9 |
0.2 |
0 |
放出热量:Q2 |
| 丙 |
1.8 |
0.9 |
0.2 |
0.1 |
放出热量:Q3 |
A.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1>-197 kJ·mol-1
B.Q1=Q2=Q3="197" kJ
C.甲、乙、丙3个容器中反应的平衡常数不相等
D.达到平衡时,丙容器中SO2的体积分数最大
在恒温下的密闭容器中,有可逆反应N2+3H2 2NH3(该反应放热),不能说明已达到平衡状态的是( )
2NH3(该反应放热),不能说明已达到平衡状态的是( )
| A.1molN≡N键断裂的同时,有6molN—H键断裂 |
| B.反应器中压强不随时间变化而变化 |
| C.v正(NH3)= v逆(H2) |
| D.混合气体平均相对分子质量保持不变 |
在一恒定的容器中充入2 mol A和1 mol B发生反应:2A(气)+B(气) x C(气),达到平衡后,C的体积分数为w%;若维持容器的容积和温度不变,按起始物质的量:A为0.6 mol;B为0.3 mol;C为1.4 mol,充入容器,达到平衡后,C的体积分数仍为w%,则x值为( )
x C(气),达到平衡后,C的体积分数为w%;若维持容器的容积和温度不变,按起始物质的量:A为0.6 mol;B为0.3 mol;C为1.4 mol,充入容器,达到平衡后,C的体积分数仍为w%,则x值为( )
| A.只能为2 | B.可能是2,也可能是3 |
| C.只能为3 | D.无法确定 |
在相同温度下(T=500 K),有相同体积的甲、乙两容器,且保持体积不变,甲容器中充入1 g SO2和1gO2,乙容器中充入2 g SO2和2 g O2。下列叙述中错误的是( )
| A.平衡时SO2的体积分数:乙>甲 | B.平衡时O2的浓度:乙>甲 |
| C.平衡时SO2的转化率:乙>甲 | D.化学反应速率:乙>甲 |
对于可逆反应:2SO2(g)+O2(g) 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
| A.升高温度 | B.增大压强 | C.使用催化剂 | D.多充入O2 |