已知某可逆反应 mA(g)+ nB(g)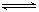 pC(g),在密闭容器中进行,下图表示在 不同反应时间 t、温度 T 和压强 P 与反应物 B 在混合气体中的百分含量 B%的关系曲线,由曲线分析,下列判断正确的是( )
pC(g),在密闭容器中进行,下图表示在 不同反应时间 t、温度 T 和压强 P 与反应物 B 在混合气体中的百分含量 B%的关系曲线,由曲线分析,下列判断正确的是( )

| A.T1<T2、P1>P2、m+n>p,△H <0; |
| B.T1>T2、P1<P2、m+n>p,△H >0; |
| C.T1>T2、P1<P2、m+n<p,△H >0; |
| D.T1<T2、P1>P2、m+n<p,△H <0; |
在体积不变的绝热密闭容器中,2molSO2与1molO2在催化剂作用下发生反应:2SO2(g)+ O2(g)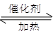 2SO3(g) △H=-QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡.下列叙述错误的是( )
2SO3(g) △H=-QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡.下列叙述错误的是( )
| A.增大氧气浓度,平衡正向移动,平衡常数不变 |
| B.降低温度,正反应速率比逆反应速率减小的程度小 |
| C.平衡时SO2气体的转化率为50% |
| D.该条件下反应放出0.5QkJ的热量 |
在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表.据此判断下列结论正确的是
| 测定时刻/s |
t1 |
t2 |
t3 |
t4 |
| c(A)/(mol/L) |
6 |
3 |
2 |
2 |
| c(B)/(mol/L) |
5 |
3.5 |
3 |
3 |
| c(C)/(mol/L) |
1 |
2.5 |
3 |
3 |
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为:2A+B⇌2C
D.在t2~t3内A的平均反应速率为:[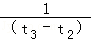 ]mol/(L•s)
]mol/(L•s)
在一密闭容器中有如下反应:aX(g)+bY(g)⇌nW(g);△H,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如图的曲线图: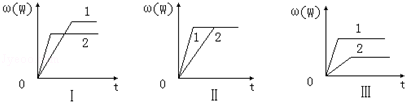
其中,ω(W)表示W在反应混合物中的体积分数,t表示反应时间.当其它条件不变时,下列分析正确的是
| A.图Ⅰ可能是不同压强对反应的影响,且p2>p1,a+b<n |
| B.图Ⅱ可能是不同压强对反应的影响,且p1>p2,n<a+b |
| C.图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好 |
| D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,△H<0 |
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)⇌CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)⇌2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积减小的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动.
| A.①④ | B.①②③ | C.②③④ | D.①②③④ |
下列相关实验能达到预期目的的是( )
| |
相关实验 |
预期目的 |
| A |
相同温度下,将等质量的大理石块、大理石粉末分别加入等体积、等浓度的盐酸和醋酸中,观察气泡产生的快慢 |
验证固体接触面积对化学反应速率的影响 |
| B |
可逆反应FeCl3(aq)+3KSCN(aq) Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 |
验证浓度对化学平衡的影响 |
| C |
室温下,向BaSO4悬浊液中加入饱和Na2CO3溶液,过滤后,再向沉淀中加入盐酸,沉淀部分溶解 |
验证BaSO4和BaCO3Ksp的相对大小 |
| D |
相同温度下,两支试管中装有等体积、等浓度的H2O2溶液,向其中分别加入少量FeCl3固体和少量的MnO2固体 |
验证不同催化剂对H2O2分解速率的影响 |
已知反应2NO2(g)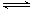 N2O4(g) △H<0,在100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
N2O4(g) △H<0,在100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
|
|
0.08 |
0.08 |
下列分析合理的是( )
A.从反应开始直至60s和80s时,二氧化氮的平均反应速率是相等的
B.80s后将容器的体积缩小为1L,平衡向正反应方向移动,气体颜色变浅
C.n1的范围是0.28<n1<0.33
D.升高温度,既能加快反应速率,也能提高N2O4的体积分数
在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)  xC(g),有图I(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,试判断对图II的说法中正确的是
xC(g),有图I(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,试判断对图II的说法中正确的是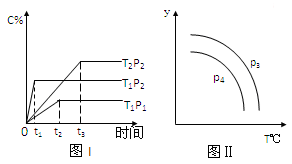
| A.若P3>P4,则y轴表示B的百分含量 |
| B.若P3>P4,则y轴表示混合气体的平均摩尔质量 |
| C.若P3<P4,则y轴表示B的体积分数 |
| D.若P3<P4,则y轴表示混合气体的密度 |
在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g) CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示。下列说法正确的是( )
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示。下列说法正确的是( )

| A.CO合成甲醇的反应为吸热反应 |
| B.该反应在T1时的平衡常数比T2时的大 |
C.平衡常数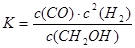 |
D.处于A点的反应体系从T1变到T2,达到平衡时 减小 减小 |
一定温度下,10mL0.4mol/LH2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表:( )
| t/min |
0 |
2 |
4 |
6 |
8 |
10 |
| V(O2)/mL |
0.0 |
9.9 |
17.2 |
22.4 |
26.5 |
29.9 |
下列叙述错误的是(溶液体积变化忽略不计)
A.反应至6min时,c(H2O2)=0.20mol/L
B.反应至6min时,H2O2分解了40%
C.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
D.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L·min)
如图是温度和压强对反应X+Y 2Z影响的示意图。下列叙述正确的是( )
2Z影响的示意图。下列叙述正确的是( )

| A.上述可逆反应的正反应为放热反应 |
| B.X、Y、Z均为气态 |
| C.X和Y中只有一种是气态,Z为气态 |
| D.上述反应的正反应的△H>0 |
符合图1、图2的反应是
A.X(g)+3Y(g) 2Z(g);ΔH>0 2Z(g);ΔH>0 |
B.X(g)+3Y(g) 2Z(g);ΔH<0 2Z(g);ΔH<0 |
C.X(g)+2Y(g) 3Z(g);ΔH<0 3Z(g);ΔH<0 |
D.5X(g)+3Y(g) 4Z(g);ΔH<0 4Z(g);ΔH<0 |
将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g) 2Z(g) ∆H< 0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
2Z(g) ∆H< 0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
| A.升高温度,X的物质的量减小 |
| B.增大压强(缩小容器体积),Z的浓度不变 |
| C.保持容器体积不变,充入一定量的惰性气体,Y的浓度不变 |
| D.保持容器体积不变,充入一定量的Z,重新平衡时,Y的体积分数增大 |
相同温度下,相同体积的甲、乙两容器,保持体积不变,甲容器中充入1g SO2和1g O2,乙容器中充入2g SO2和2g O2。下列叙述错误的是( )
| A.化学反应速率:乙>甲 | B.平衡时O2的浓度:乙>甲 |
| C.平衡时SO2的转化率:乙>甲 | D.平衡时SO2的体积分数:乙>甲 |