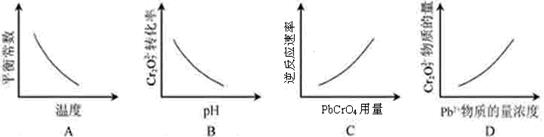
Cr2O72-可通过下列反应转化成铬黄(PbCrO4):
Cr2O72-(aq)+2Pb2+(aq)+H2O(l) 2 PbCrO4(s)+2H+(aq) ΔH< 0
2 PbCrO4(s)+2H+(aq) ΔH< 0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( )
体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应2SO2(g)+O2(g) 2SO3(g)并达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )
2SO3(g)并达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )
| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |
还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
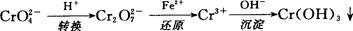
已知转化过程中的反应为
 [MCr=52,M(FeS04·7H2O)=278]
[MCr=52,M(FeS04·7H2O)=278]
转化后所得溶液中铬元素的含量为28.6 g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
| A.溶液颜色保持不变,说明上述可逆反应达到平衡状态 |
| B.若用绿矾(FeS04·7H2O)作还原剂,处理1 L废水,至少需要458.7g |
| C.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6 |
| D.2V正(CrO42-)= V逆(Cr2O72-)时,反应处于平衡态 |
向密闭容器中充入物质的量浓度均为 0.1 mol/L的CH4 和 CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
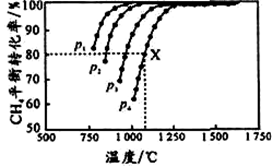
| A.平衡时CO与H2的物质的量比为1:1 |
| B.p1、p2、p3、p4由大到小的顺序为p1<p2<p3<p4 |
| C.1100℃,p4条件下,该反应10 min时达到平衡点X,则ν(CO2) = 0.008 mol•L-1•min-1 |
| D.随着温度升高,该反应的平衡常数减小 |
在相同温度和压强下,对反应CO2(g) + H2(g)  CO(g) + H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
CO(g) + H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
| 物质 物质的量 实验 |
CO2 |
H2 |
CO |
H2O |
| 甲 |
a mol |
a mol |
0 mol |
0 mol |
| 乙 |
2a mol |
a mol |
0 mol |
0 mol |
| 丙 |
0 mol |
0 mol |
a mol |
a mol |
| 丁 |
a mol |
0 mol |
a mol |
a mol |
上述四种情况达到平衡后,n (CO)的大小顺序是
A.丁>乙>丙=甲 B.乙>丁>甲>丙
C.乙=丁>丙=甲 D.丁>丙>乙>甲
某温度时,在密闭容器中发生反应:aX(g)+bY(s) 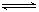 cZ(g)+dW(g),达平衡后,保持温度不变,将压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
cZ(g)+dW(g),达平衡后,保持温度不变,将压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
| A.平衡正移 | B.(a+b)<(c+d) | C.Z的体积分数变小 | D.X的转化率变大 |
设反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH=a kJ·mol-1,反应②Fe(s)+H2O(g)  FeO(s)+H2(g) ΔH=b kJ·mol-1,以上两反应的平衡常数分别为K1和K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g) ΔH=b kJ·mol-1,以上两反应的平衡常数分别为K1和K2,在不同温度下,K1、K2的值如下:
| T/K |
K1 |
K2 |
| 973 |
1.47 |
2.38 |
| 1 173 |
2.15 |
1.67 |
下列有关叙述正确的是
A.b>0 B.在973 K下增大压强,K2增大
C.a>b D.在常温下反应①一定能自发进行
在密闭容器中发生下列反应aA(g)  cC (g) + dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
cC (g) + dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
| A.A的转化率变大 | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.a < c + d |
下列各表述与示意图一致的是( )

| A.图①表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入酸体积的变化得到的滴定曲线 |
B.图②表示一定条件下进行的反应2SO2(g) + O2(g) 2SO3(g) ΔH < 0各成分的物质的量变化,t2时刻改变的条件可能是降低温度或缩小容器体积 2SO3(g) ΔH < 0各成分的物质的量变化,t2时刻改变的条件可能是降低温度或缩小容器体积 |
| C.图③表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH溶液体积的关系,在加入20 mL Ba(OH)2溶液时铝离子恰好沉淀完全 |
| D.图④表示化学反应H2(g)+C12(g)==2HCl(g)的能量变化,则该反应的反应热△H=﹢183 kJ/mol |
化学中常用图象直观地描述化学反应的进程或结果。下列图象描述正确的是
A.根据图①可判断可逆反应A2(g)+3B2(g) 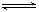 2AB3(g),正反应是吸热反应 2AB3(g),正反应是吸热反应 |
B.图②表示压强对可逆反应2A(g)+2B(g)  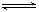 3C(g)+D(s)的影响,乙的压强大 3C(g)+D(s)的影响,乙的压强大 |
| C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
D.根据图④溶解与溶液pH的关系,若除去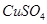 溶液中的Fe3+可向溶液中加入适量 CuO,至pH在4左右 溶液中的Fe3+可向溶液中加入适量 CuO,至pH在4左右 |
铁的氧化物可用于脱除煤气中的H2S,有关反应原理如下:
①Fe3O4(s)+3H2S(g)+H2(g)⇌3FeS(s)+4H2O(g)
②Fe2O3(s)+2H2S(g)+H2(g)⇌2FeS(s)+3H2O(g)
③FeO(s)+H2S(g)⇌FeS(s)+H2O(g)
温度与上述各反应的平衡常数的关系如图所示。下列有关说法正确的是
| A.反应①、②、③中铁的氧化物都是氧化剂 |
| B.反应①、②、③的正反应都是放热反应 |
| C.反应①、②、③中,温度越高H2S的的脱除率越高 |
| D.反应①、②、③中,压强越大H2S脱除率越高 |
一定条件下合成乙烯: 6 H2(g) +2CO2(g) CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
| A.生成乙烯的速率:v(M)一定小于v(N) |
| B.化学平衡常数:KN>K M |
| C.当温度高于250℃时,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低 |
| D.若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g) CH3OH(g)。在体积一定的密闭容器中按物质的量之比1︰2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g)。在体积一定的密闭容器中按物质的量之比1︰2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
A.该反应的△H<0,且p1<p2
B.反应速率:ν逆(状态A)>ν逆(状态B)
C.在C点时,CO转化率为75%
D.在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
已知2SO2(g)+O2 (g) 2SO3(g);△H=-197kJ•mol-1.向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3.恒温、恒容下反应达平衡时,下列关系一定正确的是( )
2SO3(g);△H=-197kJ•mol-1.向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3.恒温、恒容下反应达平衡时,下列关系一定正确的是( )
| A.容器内压强P:P甲=P丙>2P乙 |
| B.SO3的质量m:m甲=m丙>2m乙 |
| C.c(SO2)与c(O2)之比k:k甲=k丙>2k乙 |
| D.反应放出或吸收热量的数值Q:Q甲=197-Q丙>2Q乙 |