四川省成都市六校高二上学期期中联考化学试卷
下列说法正确的是:
| A.化学反应除了生成新的物质外,还伴随着能量的变化 |
| B.据能量守恒定律,反应物的总能量一定等于生成物的总能量 |
| C.放热的化学反应不需要加热就能发生 |
| D.吸热反应不加热就不会发生 |
下列方程式中,属于水解反应的是
A.CO + H2O 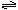 CO2 + H2 CO2 + H2 |
B.H2PO4- + H2O 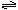 HPO42- + H3O+ HPO42- + H3O+ |
C.Cl-+ H2O 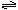 HCl+ OH- HCl+ OH- |
D.HS- + H2O 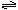 H2S + OH- H2S + OH- |
在四个不同的容器中,在不同的条件下进行合成氨反应。根据在相同时间内测定的结果判断,生成氨的速率最快的是:
| A.υ(H2)="0.1" mol·L-1·s-1 | B.υ(N2)="0.2" mol·L-1·min-1 |
| C.υ(NH3)="0.15" mol·L-1·min-1 | D.υ(H2)="0.3" mol·L-1·min-1 |
下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是 ( )
| 选项 |
A |
B |
C |
D |
| 强电解质 |
NaOH |
NaCl |
CaCO3 |
HNO3 |
| 弱电解质 |
CH3COOH |
NH3 |
H3PO4 |
Fe(OH)3 |
| 非电解质 |
Cl2 |
蔗糖 |
酒精 |
Fe |
下列过程一定释放出能量的是:
| A.化合反应 | B.分解反应 | C.分子拆成原子 | D.原子组成分子 |
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得下图,则曲线a、b、c、d所对应的实验组别可能是

| 组别 |
c(HCl)(mol/L) |
温度(℃) |
状态 |
| 1 |
2.0 |
25 |
块状 |
| 2 |
2.5 |
30 |
块状 |
| 3 |
2.5 |
50 |
粉末状 |
| 4 |
2.5 |
30 |
粉末状 |
A.4-3-2-1 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3
右图是关于反应A2(g)+3B2(g) 2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是
2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是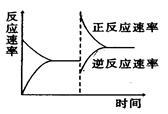
| A.升高温度,同时加压 |
| B.降低温度,同时减压 |
| C.增大反应物浓度,同时减小生成物浓度 |
| D.增大反应物浓度,同时使用催化剂 |
甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5kJ热量,则下列表示甲烷燃烧热的热化学方程式中正确的是
| A.2CH4(g) + 4O2(g) ="=" 2CO2(g) + 4H2O(l)ΔH=―1780 kJ·mol-1 |
| B.CH4(g) + 2O2(g) ="=" CO2(g) +2H2O(l)ΔH= +890 kJ·mol-1 |
| C.CH4(g) + 2O2(g) ="=" CO2(g) +2H2O(l)ΔH=―890 kJ·mol-1 |
| D.2CH4(g) + 4O2(g) ="=" 2CO2(g) + 4H2O(l)ΔH=+ 1780kJ·mol-1 |
下列说法正确的是
| A.焓减小的反应通常是自发的,能够自发进行的反应都是焓减小的反应 |
| B.熵增加的反应通常是自发的,能够自发进行的反应都是熵增加的反应 |
| C.常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0 |
| D.ΔG<0的反应是自发的,因此在任何条件均可发生 |
设反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH=a kJ·mol-1,反应②Fe(s)+H2O(g)  FeO(s)+H2(g) ΔH=b kJ·mol-1,以上两反应的平衡常数分别为K1和K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g) ΔH=b kJ·mol-1,以上两反应的平衡常数分别为K1和K2,在不同温度下,K1、K2的值如下:
| T/K |
K1 |
K2 |
| 973 |
1.47 |
2.38 |
| 1 173 |
2.15 |
1.67 |
下列有关叙述正确的是
A.b>0 B.在973 K下增大压强,K2增大
C.a>b D.在常温下反应①一定能自发进行
某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如右图所示。据图判断正确的是
| A.Ⅱ为盐酸稀释时的pH值变化曲线 |
| B.b点溶液的导电性比c点溶液的导电性强 |
| C.a点Kw的数值比c点Kw的数值大 |
| D.b点酸的总浓度大于a点酸的总浓度 |
下列事实不能用勒夏特列原理解释的是
| A.光照新制的氯水时,溶液的pH逐渐减小 |
B.高温高压有利于N2和H2转化为NH3(N2(g)+3H2(g) 2NH3(g);△H<0) 2NH3(g);△H<0) |
| C.打开汽水瓶时,有大量气泡逸出 |
| D.氨水应密闭保存于低温处 |
如右图所示:△H1=-393.5 kJ•mol-1、△H2=-395.4 kJ•mol-1, 下列说法正确的是
| A.金刚石的稳定性强于石墨 |
| B.石墨和金刚石的转化是物理变化 |
| C.C(s、石墨)==C(s、金刚石) △H=" +1.9" kJ•mol-1 |
| D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ |
在恒温恒容的密闭容器中,反应A(g)+B(s) 2C(g)达到化学平衡状态的是
2C(g)达到化学平衡状态的是
| A.消耗1molA的同时消耗1mol B |
| B.消耗n molA,同时生成2nmolC |
| C.气体的总体积不变 |
| D.容器内气体密度不变 |
已知在298K时:C(s)+ O2(g)=== CO(g) △H1 =-110.5 kJ• mol-1;C(s)+O2(g)===CO2(g) △H2=-393.5 kJ• mol-1则C(s)+CO2(g)=== 2CO(g) 的△H为
O2(g)=== CO(g) △H1 =-110.5 kJ• mol-1;C(s)+O2(g)===CO2(g) △H2=-393.5 kJ• mol-1则C(s)+CO2(g)=== 2CO(g) 的△H为
| A.+283.5 kJ• mol-1 | B.+172.5 kJ• mol-1 | C.-172.5 kJ• mol-1 | D.-504 kJ• mol-1 |
25 ℃时,水中存在电离平衡:H2O H++OH-ΔH>0。下列叙述正确的是( )
H++OH-ΔH>0。下列叙述正确的是( )
| A.将水加热,Kw增大,pH不变 |
| B.向水中加入少量NaHSO4固体,溶液的c(H+)增大,水电离的c(H+)降低 |
| C.向水中加入少量NaOH固体,平衡逆向移动,溶液的c(OH-)降低 |
| D.向水中加入少量NH4Cl固体,平衡正向移动,溶液的c(OH-)增大 |
某温度时,在密闭容器中发生反应:aX(g)+bY(s)  cZ(g)+dW(g),达平衡后,保持温度不变,将压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
cZ(g)+dW(g),达平衡后,保持温度不变,将压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
| A.平衡正移 | B.(a+b)<(c+d) | C.Z的体积分数变小 | D.X的转化率变大 |
已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H = ―Q1 KJ/mol
2H2(g)+O2(g)==2H2O(g) △H = ―Q2 KJ/mol
2H2(g)+O2(g)==2H2O(1) △H = ―Q3KJ/mol
常温下,取体积比为2:3的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为多少kJ( )
| A.0.2Q1+0.3Q3 | B.0.4Q1+0.05Q2 | C.0.2Q1+0.15Q3 | D.0.4Q1+0.1Q2 |
在相同温度和压强下,对反应CO2(g) + H2(g)  CO(g) + H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
CO(g) + H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
| 物质 物质的量 实验 |
CO2 |
H2 |
CO |
H2O |
| 甲 |
a mol |
a mol |
0 mol |
0 mol |
| 乙 |
2a mol |
a mol |
0 mol |
0 mol |
| 丙 |
0 mol |
0 mol |
a mol |
a mol |
| 丁 |
a mol |
0 mol |
a mol |
a mol |
上述四种情况达到平衡后,n (CO)的大小顺序是
A.丁>乙>丙=甲 B.乙>丁>甲>丙
C.乙=丁>丙=甲 D.丁>丙>乙>甲
下图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或者增大压强,速率的变化都符合的示意图的反应是( )

A.2SO2(g)+O2(g) 2SO3(g);△H<0 2SO3(g);△H<0 |
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);△H<0 4NO(g)+6H2O(g);△H<0 |
C.H2(g)+I2(g) 2HI(g);△H>0 2HI(g);△H>0 |
D.N2(g) +3H2(g) 2NH3(g);△H<0 2NH3(g);△H<0 |
将浓度为0.1 mol·L-1 HF溶液加水不断稀释,下列各量始终保持增大的是
| A.c(H+) | B.Ka(HF) | C.c(F-)/c(H+) | D.c(H+)/c(HF) |
一定温度下,某气体反应达到化学平衡,平衡常数K=c(A)•c2(B)/ c2(E) •c(F),恒容时,若温度适当降低,则F的浓度增加,下列说法中正确的是
A.降低温度,正反应速率减小、逆反应速率增大
B.增大c(A)、c(B),K增大
C.该反应的化学方程式为2E(g)+F(s) A(g)+2B(g)
A(g)+2B(g)
D.该反应的焓变△H>0
下列溶液一定呈酸性的是
| A.pH=6.8的溶液 |
| B.由水电离的OH-离子浓度为1×10-13 mol/L |
| C.加入酚酞,不显红色的溶液 |
| D.常温下,溶液中的H+离子浓度为5×10-7 mol/L |
下列反应的离子方程式正确的是
| A.H2S通入CuSO4溶液中 S2- + Cu2+ = CuS↓ |
| B.AgCl投入KI溶液中 Ag+ + I- = AgI↓ |
C.Na2S的水解反应 S2- + 2H2O  H2S + 2OH- H2S + 2OH- |
D.NH4NO3溶液呈酸性 NH4+ + H2O 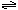 NH3•H2O + H+ NH3•H2O + H+ |
下列对溶液叙述正确的是
| A.向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小 |
| B.对于物质的量浓度相同的氢氧化钠和氨水,加水稀释至m倍和n倍后,若稀释后溶液的PH相等,则m<n |
| C.在中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,须经干燥或润洗后方可使用 |
| D.25 ℃时NH4Cl溶液的Kw大于100 ℃时NaCl溶液的Kw |
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
| ① |
10 mL 2% H2O2溶液 |
无 |
| ② |
10 mL 5% H2O2溶液 |
无 |
| ③ |
10 mL 5% H2O2溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
| ④ |
10 mL 5% H2O2溶液+少量HCl溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
| ⑤ |
10 mL 5% H2O2溶液+少量NaOH溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_______________________________。
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为_____________________。
(3)实验①和②的目的是______________________________。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_______________________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。
分析上图能够得出的实验结论是__________________________。
某化学兴趣小组做了Na2CO3的相关性质实验,请按要求回答问题:
第一步:称量10.6g Na2CO3固体全部溶于水中,配成100mL溶液;
第二步:量取5.0mL上述溶液于试管中,再滴加2滴酚酞溶液,观察到的现象是 ,请说明原因 (用离子方程式表示);
第三步:将第二步试管中的溶液均分成2份,一份微微加热,观察到的现象是 ,请说明原因: (用文字说明);另一份慢慢滴加1.0 mol/L CaCl2溶液,观察到的现象是 ;
第四步:再量取4mL Na2CO3溶液于干净的试管中,缓慢滴加1.0mol/L HCl溶液2mL,滴加过程中始终没有观察到气泡产生,请说明原因 (用离子方程式表示)。
⑴有下列四种溶液:①100mL 0.1mol/L H2SO4溶液;②100mL 0.15mol/L HCl溶液 ③100mL 0.2mol/L CH3COOH溶液;④200mL 0.1mol/L CH3COOH溶液。
其中pH最小的是 (填序号,下同),由水电离的H+浓度最大的是 ,与足量的Zn反应,生成H2最少的是 ;①和③分别与100mL 0.2mol/L NaOH溶液反应,放出热量少的是 ,理由是 。
⑵实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。该学生取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定。滴定达到终点的标志是 ;在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有________(填字母序号)。
| A.滴定终点读数时俯视 |
| B.酸式滴定管使用前,水洗后未用待测盐酸润洗 |
| C.锥形瓶水洗后未干燥 |
| D.称量NaOH固体中混有Na2CO3固体 |
E.碱式滴定管尖嘴部分有气泡,滴定后消失
某温度(T ℃)下的溶液中,c(H+)=10-x mol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示,请回答下列问题:

(1)此温度下,水的离子积Kw为________,则该温度T______25(填“>”、“<”或“=”)。
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
| 实验序号 |
Ba(OH)2溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
| ① |
22.00 |
0.00 |
8 |
| ② |
22.00 |
18.00 |
7 |
| ③ |
22.00 |
22.00 |
6 |
假设溶液混合前后的体积变化忽略不计,则a=________,实验②中由水电离产生的c(OH-)=______mol·L-1。
(3)在此温度下,将0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
| |
甲 |
乙 |
丙 |
丁 |
| 0.1 mol·L-1 Ba(OH)2溶液体积/mL |
10 |
10 |
10 |
10 |
| 0.1 mol·L-1 NaHSO4溶液体积/mL |
5 |
10 |
15 |
20 |
①按丁方式混合后,所得溶液显________(填“酸”、“碱”或“中”)性。
②写出按乙方式混合后,反应的离子方程式:________________________。
③按甲方式混合后,所得溶液的pH为__________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号