在某一容积为2 L的密闭容器中,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=—a kJ/mol(a>0),反应达平衡后,测得c(CO)∶c(CO2)=3∶2,下列说法正确的是
CO2(g)+H2(g) ΔH=—a kJ/mol(a>0),反应达平衡后,测得c(CO)∶c(CO2)=3∶2,下列说法正确的是
| A.反应放出的热量为0.04a kJ |
| B.若将容器的体积压缩为1 L,有利于该平衡正向移动 |
| C.平衡时H2O的转化率为40% |
| D.CO、H2O、CO2、H2的浓度都相等时反应达到平衡 |
一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
| 容器编号 |
温度(℃) |
起始物质的量(mol) |
平衡物质的量(mol) |
|
| CH3OH(g) |
CH3OCH3(g) |
H2O(g) |
||
| I |
387 |
0.20 |
0.080 |
0.080 |
| Ⅱ |
387 |
0.40 |
|
|
| Ⅲ |
207 |
0.20 |
0.090 |
0.090 |
下列说法正确的是
A.该反应的正反应为吸热反应
B.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)⇌SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如右所示.由图可得出的正确结论是
| A.反应在c点达到平衡状态 |
| B.反应物浓度:a点小于b点 |
| C.反应物的总能量低于生成物的总能量 |
| D.△t1=△t2时,SO2的转化率:a~b段小于b~c段 |
在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g) 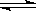 H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为
| A.25% | B.50% | C.75% | D.80% |
体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g)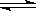 2SO3(g)并达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
2SO3(g)并达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
| A.等于p% | B.大于p% |
| C.小于p% | D.无法判断 |
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为CO(g)+ H2O(g)  CO2(g) + H2(g) △H <0,反应达到平衡后,为提高CO的转化率,下列措施中正确的是
CO2(g) + H2(g) △H <0,反应达到平衡后,为提高CO的转化率,下列措施中正确的是
| A.增加压强 | B.降低温度 | C.增大CO 的浓度 | D.更换催化剂 |
下列叙述中,不能用平衡移动原理解释的是
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.高压比常压有利于合成SO3的反应 |
| C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| D.黄绿色的氯水光照后颜色变浅 |
在密闭容中发生下列反应aA(g) cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
| A.A的转化率变大 | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.a < c+d |
当下列反应达到平衡时,保持温度不变,向容器中充入氩气,平衡一定不移动的是
A.N2(g)+3H2(g)  2NH3(g) 2NH3(g) |
B.2HI(g)  H2(g)+I2(g) H2(g)+I2(g) |
C.PCl5(g)  PCl3(g)+Cl2(g) PCl3(g)+Cl2(g) |
D.2SO2(g)+O2(g)  2SO3(g) 2SO3(g) |
合成氨的反应是:N2(g)+3H2(g) 2NH3(g);△H<0。使产率增大的方法是
2NH3(g);△H<0。使产率增大的方法是
| A.升高温度 | B.降低压强 | C.使用催化剂 | D.及时分离出NH3 |
恒温时,固定容积的容器内发生如下反应:2NO2(g) N2O4(g) 达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数
N2O4(g) 达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数
| A.不变 | B.增大 | C.减小 | D.无法判断 |
可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是
R(g)+S(g)在恒温下已达到平衡的是
| A.反应容器内的压强不随时间改变 |
| B.反应容器内P、Q、R、S四者共存 |
| C.P的生成速率和S的生成速率相等 |
| D.反应容器内的气体总物质的量不随时间变化 |
在2L密闭容器内,按物质的量之比为2︰1投入NO和O2。某温度下发生如下反应:
2NO(g) + O2(g) 2NO2(g),n(NO)随时间的变化如表:
2NO2(g),n(NO)随时间的变化如表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.015 |
0.012 |
0.010 |
0.010 |
0.010 |
下列说法不正确的是
A.在0~2s内,v(O2)=0.002mol·L-1·s-1
B.5s后向容器中通入0.02mol NO2,再次平衡后,0.020mol<n(NO2)<0.040 mol
C.在该温度时,向容器中加入O2,平衡将正向移动,平衡常数增大
D.5s后,向反应容器中同时通入各0.01mol的NO、O2、NO2,平衡向正向移动
在一定温度下,向体积恒定为2 L的密闭容器中充入2mol M和一定量的N,发生如下反应:M(g)+N(g) E(g)。当反应进行到4 min 时达到平衡,测得M的浓度为0.2 mol/L。下列说法正确的是( )
E(g)。当反应进行到4 min 时达到平衡,测得M的浓度为0.2 mol/L。下列说法正确的是( )
| A.4 min时,E的物质的量浓度为1.6mol/L |
| B.4 min时,用M表示的化学反应速率为0.8mol/(L·min) |
| C.4 min后,向容器中充入不参与反应的稀有气体,M的物质的量减小 |
| D.4 min时,M的转化率为80% |