北京市西城区高三上学期期末考试化学试卷
化学与日常生活紧密相关。下列说法中,不正确的是
| A.甲醛可作食品防腐剂 | B.氢氧化铝可作抗酸药 |
| C.氯化钠可作食品调味剂 | D.生石灰可作食品干燥剂 |
下列化学用语正确的是
| A.丙烯的实验式C3H6 | B.镁离子的结构示意图 |
C.CO2的电子式 |
D.中子数为18的氯原子符号  |
酸雨形成的示意图如下图。下列说法中,不正确的是
| A.汽车尾气是导致酸雨的原因之一 |
| B.酸雨会使土壤、湖泊酸化 |
| C.酸雨形成中不涉及氧化还原反应 |
| D.燃煤中加入石灰石可防治酸雨 |
下列说法中,不正确的是
| A.麦芽糖水解的产物只有葡萄糖 |
| B.苯酚可用于合成高分子化合物 |
| C.油脂水解可以制取高级脂肪酸 |
| D.鸡蛋清遇醋酸铅后产生的沉淀能重新溶于水 |
白屈菜有止痛、止咳等功效,从其中提取的白屈菜酸的结构简式如图。下列有关白屈菜酸的说法中,不正确的是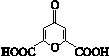
| A.分子式是C7H4O6 | B.能发生加成反应 |
| C.能发生水解反应 | D.能发生缩聚反应 |
下列离子方程式中,正确的是
| A.钠放入水中 Na+H2O=Na++OH-+H2↑ |
B.电解饱和食盐水2Cl-+2H2O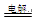 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
| C.实验室用氯化铝溶液和氨水制氢氧化铝 Al3++3OH-=Al(OH)3↓ |
| D.向碳酸氢铵溶液中加入足量氢氧化钠溶液 HCO3-+OH-=CO32-+H2O |
常温下,下列各组离子在指定溶液中,一定可以大量共存的是
| A.无色溶液中 Mg2+、Al3+、SO42-、CO32- |
| B.pH=1的溶液中NH4+、Ba2+、HCO3-、NO3- |
| C.含MnO4-的溶液中 H+、K+、Br-、I- |
D.在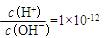 的溶液中Na+、K+、CH3COO-、SO42- 的溶液中Na+、K+、CH3COO-、SO42- |
下列说法中,不正确的是
| A.酚能与碳酸氢钠溶液反应 | B.醛能发生银镜反应 |
| C.多肽既能与酸又能与碱反应 | D.烯烃能与酸性高锰酸钾溶液反应 |
将0.2 mol·L-1的KI溶液和0.05 mol·L-1 Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I- 2Fe2++I2”的是
2Fe2++I2”的是
| 实验编号 |
实验操作 |
实验现象 |
| ① |
滴入KSCN溶液 |
溶液变红色 |
| ② |
滴入AgNO3溶液 |
有黄色沉淀生成 |
| ③ |
滴入K3[Fe(CN)6]溶液 |
有蓝色沉淀生成 |
| ④ |
滴入淀粉溶液 |
溶液变蓝色 |
A.①和② B.②和④ C.③和④ D.①和③
NA为阿伏加德罗常数的值。下列说法中,正确的是
| A.标准状况下,22.4L庚烷的分子数约为NA |
| B.密闭容器中23gNO2与N2O4的混合气体中氮原子数为0.5NA |
| C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA |
| D.1L0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |
4种短周期元素X、Y、Z、W的原子序数依次增大,依据表中信息判断,下列说法不正确的是
| 元素 |
X |
Y |
Z |
W |
| 相关 信息 |
有两种常见的单 质,均有氧化性 |
短周期中原子半 径最大的元素 |
地壳中含量最多 的金属元素 |
最外层电子数是 电子层数的二倍 |
A.Y的单质燃烧火焰呈黄色
B.4种元素的简单离子半径最小的是Z
C.X与Y形成的化合物只含有离子键
D.Y、Z、W的最高价氧化物对应的水化物两两之间均能反应
已知氯水中存在反应:Cl2+H2O H++Cl-+HClO,取5 mL饱和氯水进行如下实验。下列说法中,正确的是
H++Cl-+HClO,取5 mL饱和氯水进行如下实验。下列说法中,正确的是
| A.加5 mL水,c (H+)增大 | B.加少量NaCl固体,c (H+)不变 |
| C.加少量碳酸钙粉末,c(HClO)升高 | D.加少量Na2SO3固体,溶液pH升高 |
利用海水提取溴和镁的过程如下,下列说法不正确的是
| A.工业溴中含少量Cl2,可用NaOH溶液除去 |
| B.工业上常利用电解熔融MgCl2冶炼金属镁 |
| C.富集溴元素过程中,空气吹出法利用了溴易挥发的性质 |
| D.若提取1 mol Br2,至少需要标准状况下44.8 L的Cl2 |
用下列装置(尾气处理已略去)进行相关实验,能实现实验目的的是
| |
实验目的 |
a中试剂 |
b中试剂 |
 c c中试剂 |
| A |
比较H2CO3、H2SiO3 的酸性 |
醋酸溶液 |
碳酸钠 |
硅酸钠溶液 |
| B |
比较Cl2、I2的 氧化性 |
浓盐酸 |
高锰酸钾 |
碘化钾溶液 |
| C |
制备NaHCO3 |
盐酸 |
大理石 |
饱和碳酸钠溶液 |
| D |
证明C2H2有还原性 |
饱和食盐水 |
电石 |
酸性高锰酸钾溶液 |
利用催化技术可将汽车尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+2CO 2CO2+N2。某温度下,在容积不变的密闭容器中通入NO和CO,
2CO2+N2。某温度下,在容积不变的密闭容器中通入NO和CO,
测得不同时间的NO和CO的浓度如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO)/×10-3mol·L-1 |
1.00 |
0.45 |
0.25 |
0.15 |
0.10 |
0.10 |
| c(CO)/×10-3mol·L-1 |
3.60 |
3.05 |
2.85 |
2.75 |
2.70 |
2.70 |


 下列说法中,不正确的是
下列说法中,不正确的是 A.2s内的平均反应速率υ(N2)=1.875×10-4mol·L-1·s-1
A.2s内的平均反应速率υ(N2)=1.875×10-4mol·L-1·s-1 B.在该温度下,反应的平衡常数K=5
B.在该温度下,反应的平衡常数K=5 C.若将容积缩小为原来的一半,NO转化率大于90%
C.若将容积缩小为原来的一半,NO转化率大于90% D.使用催化剂可以提高单位时间CO和NO的处理量
D.使用催化剂可以提高单位时间CO和NO的处理量
卤族元素的单质能与H2反应
| H2+F2=2HF |
在暗处能剧烈化合并发生爆炸 |
| H2+Cl2=2HCl |
光照或点燃发生反应 |
| H2+Br2=2HBr |
加热至一定温度才能反应 |
| H2+I2=2HI |
不断加热才能缓慢反应,生成的HI会分解 |
(1)卤族元素位于周期表中的__________族。
(2)用电子式表示HCl的形成过程__________。
(3)依据上表,可以推测出:随着原子序数的递增,__________(填字母)。
a. 单质的熔沸点逐渐升高 b. 元素的非金属性逐渐减弱
c. 卤化氢的还原性依次减弱 d. 卤化氢的稳定性依次减弱
(4)不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近。写出BrCl和SO2在水溶液中发生反应的化学方程式____________。
用0.1 mol·L-1 NaOH溶液分别滴定体积均为20 mL、浓度均为0.1 mol·L-1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图:

(1)HX为 酸(填“强”或“弱”)。
(2)N点pH>7的原因是(用化学用语表示)______________。
(3)下列说法正确的是__________(填字母)。
a. M点c(HX)<c(X-)
b. M点c(Na+)>c(OH-)
c. P点c(Cl-)=0.05 mol·L-1
富铁铝土矿(主要含有A12O3、Fe2O3、FeO和SiO2)可制备新型净水剂液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n]。研究发现,当a=b时净水效果最好。工艺流程如下(部分操作和产物略):
(1)A12O3与H2SO4发生反应的离子方程式是____________。
(2)测得滤液中 。加入FeSO4·7H2O和H2O2的作用是(结合化学用语说明)____________。
。加入FeSO4·7H2O和H2O2的作用是(结合化学用语说明)____________。
(3)将溶液A电解得到液体聚合硫酸铝铁。装置如图所示(阴离子交换膜只允许阴离子通过,电极为惰性电极)
① 阴极室的电极反应式是__________。
② 电解过程阳极室溶液pH的变化是____________(填“增大”、“减小”或“不变”)。
③ 简述在反应室中生成液体聚合硫酸铝铁的原理____________。
铜冶金技术以火法冶炼为主。
(1)火法炼铜的工艺流程如下:
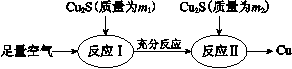
反应Ⅰ:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ΔH =" -768.2" kJ·mol-1
反应II:2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) ΔH =" +116.0" kJ·mol-1
①在反应Ⅱ中,每生成1 mol SO2转移电子________mol。
②反应Cu2S(s)+O2(g) =2Cu(s)+SO2(g)的ΔH =________ kJ·mol-1。
③ 理论上m1:m2=________。
(2)炼铜的副产品SO2多用于制硫酸和石膏等化学产品。
①制硫酸中重要的一步反应是
2SO2(g)+O2(g) 2SO3(g) ΔH =" -196" kJ·mol-1。
2SO3(g) ΔH =" -196" kJ·mol-1。
右图表示将2.0 mol SO 2 和1.0 mol O 2 置于1 L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,X(X1、X2)代表压强或温度。
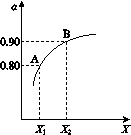
X代表的物理量是________。A对应条件下平衡常数K=________。
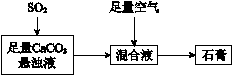
② 下图表示的是生产石膏的简单流程,请用平衡移动原理解释向CaCO3悬浊液中通入SO 2发生反应的原因________。
(3)工业硫酸中往往含有一定量SO 2 ,测定过程如下:取m g工业硫酸配成100 mL溶液,取出20.00 mL溶液,加入1 mL指示剂,用c mol·L-1 I2标准溶液滴定,消耗的I2标准溶液V mL,工业硫酸中含有SO2的质量分数的计算式是________。
硝酸是氧化性酸,其本质是NO3-有氧化性,某课外实验小组进行了下列有关NO3-氧化性的探究(实验均在通风橱中完成)。
(1)实验Ⅰ中,铝片作________(填“正”或“负”)极。液面上方产生红棕色气体的化学方程式是________。
(2)实验Ⅱ中电流计指针先偏向右边后偏向左边的原因是________。

查阅资料:活泼金属与1 mol·L-1稀硝酸反应有H2和NH4+生成,NH4+生成的原理是产生H2的过程中NO3-被还原。
(3)用上图装置进行实验Ⅲ:溶液X为1 mol·L-1稀硝酸溶液,观察到电流计指针向 右偏转。
① 反应后的溶液中含NH4+。实验室检验NH4+的方法是________。
② 生成NH4+的电极反应式是________。
(4)进一步探究碱性条件下NO3-的氧化性,进行实验Ⅳ:

① 观察到A中有NH3生成,B中无明显现象。A、B产生不同现象的解释是________。
②A中生成NH3的离子方程式是________。
(5)将铝粉加入到NaNO3溶液中无明显现象,结合实验Ⅲ和Ⅳ说明理由____________。
用烃A合成高分子化合物N的过程如下:
已知:
回答下列问题:
(1)烃A的相对分子质量为26,A的结构简式是________。
(2)B中所含官能团的名称是________。
(3)C和D反应生成E的化学方程式是________。
(4)B和F反应生成G的化学方程式是________。
(5)H中含有一个甲基,H的结构简式是________。
(6)E和K反应生成M的化学方程式是________。
(7)N和NaOH溶液反应的化学方程式是________。
(8)有机物Q是M的同分异构体,与M具有相同官能团,水解可以生成D,存在顺反异构,Q的顺式结构简式是________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号