湖南省长沙市望城区高二上学期期末理化学试卷
可逆反应在一定条件下达到化学反应限度时,下列说法正确的是
| A.反应停止了 |
| B.正反应速率与逆反应速率均为零 |
| C.反应物和生成物浓度相等 |
| D.正反应速率和逆反应速率相等 |
下列各种试纸,在使用时预先不能用蒸馏水润湿的是
| A.红色石蕊试纸 | B.蓝色石蕊试纸 | C.KI淀粉试纸 | D.pH试纸 |
量取25.00mL硫酸溶液,可选用的仪器是
| A.50mL量筒 | B.25mL量筒 |
| C.50mL碱式滴定管 | D.50mL酸式滴定管 |
将下表中各组的两电极用导线相连后放入盛有对应该组的溶液中,能产生电流的是
| 序号 |
电极1 |
电极2 |
溶液 |
| A |
Cu |
Cu |
稀H2SO4 |
| B |
Ag |
Zn |
稀H2SO4 |
| C |
Cu |
Cu |
酒精 |
| D |
C |
C |
ZnSO4溶液 |
有下列盐:①FeCl3 ②CH3COONa ③NaCl,其水溶液的pH由大到小排列正确的是
| A.①>③>② | B.②>③>① | C.③>②>① | D.①>②>③ |
在恒容的密闭容器中,下列能够判断可逆反应2A(g)+3B(g) 4C(g)+D(g) 已达到化学平衡状态的是
4C(g)+D(g) 已达到化学平衡状态的是
| A.单位时间内生成3n molB,同时消耗4n molC |
| B.容器内压强不随时间变化 |
| C.混合气体的密度不随时间变化 |
| D.B物质的百分含量不变 |
下列实验中,指定使用的仪器必须预先干燥的是
| A.喷泉实验中用于收集氨气的烧瓶 |
| B.中和滴定中用的滴定管 |
| C.配制一定物质的量浓度溶液实验用的容量瓶 |
| D.排水法收集氧气实验用的集气瓶 |
已知:反应2A+3B=C+D在某段时间内,以A的浓度变化表示的反应速率为1mol/(L·min),则此段时间内,以C的浓度变化表示的化学反应速率为
| A.0.5 mol/(L·min) | B.2mol/(L·s) | C.2mol/(L·min) | D.3mol/(L·min) |
设吸热反应C+CO2  2CO的反应速率为v1,放热反应N2+3H2
2CO的反应速率为v1,放热反应N2+3H2  2NH3的反应速率为v2,当温度升高时,v1和v2的变化情况为
2NH3的反应速率为v2,当温度升高时,v1和v2的变化情况为
| A.同时增大 | B.同时减小 | C.增大,减小 | D.减小,增大 |
一定温度下,反应N2(g)+O2(g)  2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是
2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是
| A.缩小体积 | B.恒容,充入He | C.恒容,充入O2 | D.恒压,充入N2 |
能使H2O  H++ OHˉ电离平衡向正反应方向移动,而且所得溶液显酸性的是
H++ OHˉ电离平衡向正反应方向移动,而且所得溶液显酸性的是
| A.将水加热到99℃,使水的pH=6.1 | B.在水中滴入稀H2SO4 |
| C.在水中加入Na2CO3固体 | D.在水中加入氯化铜固体 |
在pH=1的溶液中,下列各组离子能够大量共存的是
| A.Fe3+、Mg2+、ClO-、SO42- | B.Cu2+、Fe3+、NO3-、SO42- |
| C.Na+、NH4+、CO32-、NO3- | D.K+、HCO3-、Cl-、NH4+ |
大量使用会导致全球进一步变暖、雾霸天气增多的是下列能源中的
| A.化石能源 | B.太阳能 | C.氢能 | D.地热能 |
常温下,0.1mol/L的氯化铵溶液中,离子浓度最大的是
| A.Cl- | B.OH- | C.H+ | D.NH4+ |
关于由锌片、铜片和稀硫酸组成的原电池的说法中,正确的是
| A.电解质溶液的pH保持不变 | B.电流方向是由锌片流向铜片 |
| C.锌片作正极,发生还原反应 | D.锌片质量逐渐减少,铜片上有气泡产生 |
下列离子方程式中,属于水解反应的是
A.HCOOH + H2O HCOO-+ H3O+ HCOO-+ H3O+ |
B.CO2 + H2O HCO3- + H+ HCO3- + H+ |
C.CO32- + H2O HCO3- + OH- HCO3- + OH- |
D.HS-+ H2O S2-+ H3O+ S2-+ H3O+ |
将①H+、②NH4+、③NO3-、④K+、⑤CO32-、⑥OH-分别加入H2O中,基本上不影响水的电离平衡的是
| A.③④ | B.②③⑥ | C.①⑥ | D.②④ |
室温下,pH均为12的两种溶液:①氨水.②氢氧化钠溶液。下列说法不正确的是
| A.两溶液中c(OH-):①=② |
| B.两溶液的物质的量浓度:①=② |
| C.两溶液分别加水稀释10倍,稀释后溶液的pH:①>② |
| D.等体积的两溶液分别与同浓度的盐酸完全中和,消耗盐酸的体积:①>② |
升高温度,下列数据不一定增大的是
A.化学反应速率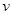 |
B.弱酸的电离平衡常数Ka |
| C.化学平衡常数K | D.水的离子积常数KW |
下列实验或现象能证明某硫酸铝溶液中含的杂质一定为Fe3+的是
| A.加入足量氢氧化钠溶液后产生的浑浊不溶解 |
| B.用pH试纸检验呈弱酸性 |
| C.滴入KSCN溶液后溶液变血红色 |
| D.溶液显浅黄色 |
用锌片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
| A.加热 | B.改用98%的浓硫酸 |
| C.改用锌粒 | D.滴加少量CuSO4溶液 |
已知:Ksp(AgCl)=1.8×10-10;Ksp(Ag2S)=6.3×10-50。向盛0.1mol/L AgNO3溶液的试管中滴加0.1mol/L Na2S溶液至沉淀完全,再滴加足量NaCl溶液,产生的现象或生成的物质是
| A.黑色沉淀完全转化为白色沉淀 | B.既有氯化银也有硫化银 |
| C.只产生黑色硫化银沉淀 | D.只有氯化银白色沉淀 |
已知甲醇的燃烧热数值为726.51kJ·mol-1。下列热化学方程式书写正确的是
| A.CH4O+3/2O2=CO2+2H2O △H=-726.51 kJ·mol-1 |
| B.CH4O(l)+ 3/2O2(g)=CO2(g)+2H2O(g) △H="+726.51" kJ·mol-1 |
| C.2CH4O(l)+3O2(g)=2CO2(g)+4H2O(l) △H="+1453.12" kJ·mol-1 |
| D.CH4O(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-726.51 kJ·mol-1 |
现有6种物质:①NaCl晶体 ②液态SO3 ③液态的醋酸 ④汞 ⑤BaSO4固体 ⑥酒精。 请用序号回答下列问题:
(1)属于强电解质的是______;(2)属于弱电解质的是__________;
(3)属于非电解质的是__________。
简要回答下列问题。
(1)氯化铵常用作除锈剂,其水溶液呈酸性的原因是_____________________。
(2)硫酸铝水解的离子方程式是_______________,为了抑制其水解,配制时可以加入少量的__________。
(3)泡沫灭火器中装的灭火剂主要包括硫酸铝溶液、碳酸氢钠溶液。泡沫灭火器内置的玻璃筒应装_______溶液,外部的铁筒装另一种溶液。
“西气东输”的气体是指天然气,主要成分是甲烷。工业上用碳与水在高温下反应制得水煤气。水煤气的主要成分是CO和H2,两者体积比约为1:1。1mol CO气体完全燃烧生成CO2气体放出283kJ热量,1molH2完全燃烧生成气态水放出242kJ热量;1molCH4气体完全燃烧生成CO2气体和气态水放出802kJ热量。
(1)写出H2完全燃烧生成气态水的热化学反应方程式:_________________________;
(2)忽略水煤气中其它成分,相同状况下若产生相等的热量,则所需水煤气体积是甲烷体积的________倍,水煤气放出CO2的体积是甲烷放出CO2的体积的__________倍。
(3)以天然气代替水煤气作民用燃料,突出的优点是__________和_________。(任写2点)
已知:2X(g)+ Y(g) a Z(g),在T1温度下,体积为2L的密闭容器中,充入6mol X和2mol Y。根据图示回答:
a Z(g),在T1温度下,体积为2L的密闭容器中,充入6mol X和2mol Y。根据图示回答:

(1)a =________;用Y的浓度变化表示从反应开始到平衡时的平均反应速率为___________mol/(L•min)。
(2)平衡时,Y在混合物中的物质的量分数是___________。
(3)其他条件不变时,下列措施可以提高Y的转化率的是___________(选填字母)。
A.使用适当的催化剂 B.分离出Z C.增大容器体积
研究性学习小组探究金属锈蚀的条件,进行如下对照实验:

(1)数天后铁钉明显锈蚀的装置是 ;
(2)铁制品锈蚀的条件是 ;
(3)铁钉生锈主要属于 腐蚀(填“化学”或“电化学”);
原电池和电解池都能实现能量的置换。回答下列问题:
(1)可将化学能转化为电能是_________池;
(2)下列反应能设计成原电池的是:
① 2FeCl3+Fe=3FeCl2
② AlCl3+3NH3·H2O= Al(OH)3↓+3NH4Cl
③ NaOH+HC1=NaC1+H2O
(3)用FeCl3溶液腐蚀印刷电路铜板的离子方程式为: 。
(4)右图装置当闭合电键时,电表显示有电流通过。则Pt极的电极反应式: ; 当甲中产生0.1 mol气体时,乙中析出铜的质量应为________g。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号