(1)已知:①Fe(s)+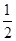 O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
②2Al(s)+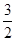 O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是 。
某同学认为,铝热反应可用于工业炼铁,你的判断是 (填“能”或“不能”),
你的理由是 。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,
如图所示。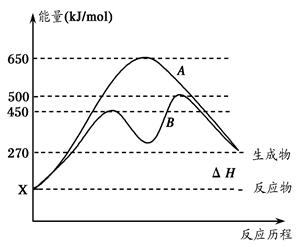
①据图判断该反应是___(填“吸”或“放”)热反应,当反应达到平衡后,其他
条件不变,升高温度,逆反应速率将____(填“增大”、“减小”或“不变”)。
②其中B历程表明此反应采用的条件为________(填字母)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)已知热化学方程式:H2(g)+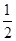 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为 。
工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生成二氧化碳,其三步反应如下:
① 2H2 (g)+CO(g)  CH3OH (g) ΔH= -90.8 kJ·mol-1
CH3OH (g) ΔH= -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+H2O(g)  CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
(1)总合成反应的热化学方程式为 。
(2)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是_____(填字母代号)。
A 高温高压 B 加入催化剂 C 减少CO2的浓度
D 增加CO的浓度 E 分离出二甲醚
(3)反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验 序号 |
温度 浓度 时间 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
①实验1,反应在10至20分钟时间内用CH3OH(g)表示的平均速率为 。
②实验2,CH3OH(g)的初始浓度c2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
③设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填>、=、<),且c3= mol/L。
(1)已知:①Fe(s)+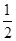 O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-272.0 kJ·mol-1;
②2Al(s)+ O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
O2(g)===Al2O3(s) ΔH2=-1675.7 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是 。
某同学认为,铝热反应可用于工业炼铁,你的判断是 (填“能”或“不能”),
你的理由是 。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,
如图所示。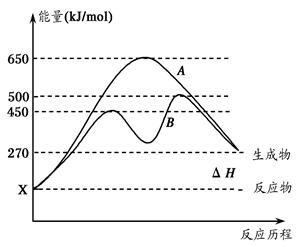
①据图判断该反应是___(填“吸”或“放”)热反应,当反应达到平衡后,其他
条件不变,升高温度,逆反应速率将____(填“增大”、“减小”或“不变”)。
②其中B历程表明此反应采用的条件为________(填字母)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)已知热化学方程式:H2(g)+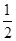 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为 。
.联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。(1)已知:2NO2(g) N2O4(g),N2O4为无色气体。
N2O4(g),N2O4为无色气体。
① 在上述条件下反应能够自发进行,则反应的ΔH 0(填写“>”、“<”、“=”)
② 一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡,达到平衡状态的标志 。
N2O4(g)达到平衡,达到平衡状态的标志 。
A单位时间内生成n mol N2O4的同时生成2 nmolNO2
B用NO2、N2O4的物质的量浓度变化表示的反应速率之比为2:1的状态
C混合气体的颜色不再改变的状态
D混合气体的密度不再改变的状态
E混合气体的平均相对分子质量不再改变的状态
③ 其他条件不变时,下列措施能提高NO2转化率的是 (填字母)
| A.减小NO2的浓度 | B.降低温度 | C.增大压强 | D.升高温度 |
(2)25℃时,1molN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放612.5 kJ的热量。请写出该反应的热化学方程式: 。
(3) 17℃、1.01×105Pa,往10L密闭容器中充入NO2,达到平衡时,c(NO2)="0.2" mol·L-1,
c(N2O4)="0.16" mol·L-1。则反应初始时,充入NO2的物质的量为 ;NO2的转化率为 ;该温度下该反应的平衡常数K为 ;该温度下反应N2O4(g)  2NO2(g)的平衡常数K为 。
2NO2(g)的平衡常数K为 。
(15分)用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下: 3SiCl4(g)+2N2(g)+6H2(g)  Si3N4(s)+12HCl(g)(△H<0) 完成下列填空:
Si3N4(s)+12HCl(g)(△H<0) 完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2 L,3 min后达到平衡,测得固体的质量增加 了2.80 g,则H2的平均反应速率 mol/(L·min);该反应的平衡常数表达式K= 。
(2)上述反应达到平衡后,下列说法正确的是________。
a.其他条件不变,压强增大,平衡常数K减小
b.其他条件不变,温度升高,平衡常数K减小
c.其他条件不变,增大Si3N4物质的量平衡向左移动
d.其他条件不变,增大HCl物质的量平衡向左移动
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是 。
a.3v逆(N2)=v正(H2) b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变 d.c(N2):c(H2):c(HCl)=1:3:6
(4)若平衡时H2和HCl的物质的量之比为 ,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比 (填“>”、“=”或“<”)。
(10分)两种气态单质X和Y能直接化合生成Z(可逆反应),如将X和Y按一定比例混合并压入密闭容器中,在不同温度下经过一段时间后,反应混合物中X的含量变化如下图所示,回答下列问题:
(1)上述X与Y化合生成Z的反应是__________反应(填“放热”或“吸热”);
(2)温度低于T℃时,反应混合物中X的含量 (填“逐渐增大”,“不变”,“逐渐减小”),原因是______________________________;温度高于T℃时,反应混合物中X的含量__________(填“逐渐增大”,“不变”,“逐渐减小”),原因是________________。
(1)已知可逆反应:M(g)+N(g)P(g)+Q(g) ΔH>0,请回答下列问题:
①在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1,c(N)="2.4" mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 ;
②若反应温度不变,反应物的起始浓度分别为:c(M)="4" mol·L-1,c(N)="a" mol·L-1;达到平衡后,c(P)="2" mol·L-1,a= ;
(2)甲、乙两瓶氨水的浓度分别为1 mol·L-1和0.1 mol·L-1,则甲、乙两瓶氨水中c(OH-)之比_______(填“大于”、“小于”或“等于”)10,说明理由_____________________________。
(3)25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):
| ①H2SO4溶液: HSO4- 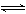 H++SO42- H++SO42- |
②NaHSO4溶液: HSO4- 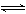 H++SO42- H++SO42- |
③盐酸 HCl=H++Cl |
| 10% |
29% |
100% |
25℃时,0.1mol/L上述几种溶液加入完全一样的等量锌粒,反应速率从大到小的顺序
是 (填序号)
②25℃时,c(H+)相同的上述几种溶液,其物质的量浓度由大到小的顺序是 (填序号)
③25℃时,0.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度的原因是________________ 。
某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,测得CO2和CO浓度随时间的变化如图所示:
FeO(s)+CO(g) ΔH=a kJ·mol-1,测得CO2和CO浓度随时间的变化如图所示:
(1) 0~8 min,v(CO)=__________mol·L-1·min-1。
(2) 测得在不同温度下,K值如下:
| 温度(℃) |
500 |
700 |
| 平衡常数K |
2.00 |
2.50 |
①若500℃时进行反应,CO2起始浓度为3 mol·L-1,CO的平衡浓度为________。
②反应中的a________0(填“大于、小于、等于”)。
③下列措施中,能使平衡时c(CO)/c(CO2)的比值的增大的是________(填序号)。
A.升高温度 B.再加入一些铁粉 C.增大压强 D.充入一定量氮气
④在700℃时的某时刻测得CO2浓度为1.4mol·L-1,CO浓度为2.0mol·L-1,反应向 方向进行(填“正反应”或”逆反应”),理由是: 。
在一定温度下的恒容密闭容器中,可逆反应达到平衡状态时,一些宏观物理量恒定不变:a.各物质的浓度不变,b.平衡混合物中各组分的物质的量分数或质量分数不变,c.容器内气体压强不变,d.容器内气体密度不变,e.容器内气体颜色不变。
(1)能说明反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的有________;
2NH3(g)达到平衡状态的有________;
(2)能说明反应H2(g)+I2(g) 2HI(g)达到平衡状态的有________;
2HI(g)达到平衡状态的有________;
(3)能说明反应2NO2(g) N2O4(g)达到平衡状态的有________。
N2O4(g)达到平衡状态的有________。
(10分)在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:
N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的浓度比是________;
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________,密度________。(填“变大”“变小”或“不变”)
(3)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”“小于”或“等于”)原来的2倍。
(10分)在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:
N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的浓度比是________;
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________,密度________。(填“变大”“变小”或“不变”)
(3)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”“小于”或“等于”)原来的2倍。
( I) 在一个容积固定不变的密闭容器中进行反应:
2X(g) + Y(g)  2Z(g) 若把2molX和1molY充入该容器时,处于状 态I, 反应在绝热条件下达到平衡时处于状态II(如下图),则该反应的△H 0; ( 填:“< ,> , = ”)。该反应在 (填:高温或低温)条件下能自发进行。
2Z(g) 若把2molX和1molY充入该容器时,处于状 态I, 反应在绝热条件下达到平衡时处于状态II(如下图),则该反应的△H 0; ( 填:“< ,> , = ”)。该反应在 (填:高温或低温)条件下能自发进行。
(II)在容积可变的密闭容器中发生反应:mA(g) + nB(g)  pC(g) ,
pC(g) ,
在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如
下表
| 压强p/Pa |
2×105 |
5×105 |
1×106 |
| c(A)/mol·L-1 |
0.08 |
0.20 |
0.44 |
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不)
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是 mol.
(3)当压强为1×106 Pa时,此反应的平衡常数表达式: 。
(4)其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,
A的转化率随时间变化如下图,请在图中补充画出压强分别为5×105 Pa
和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)。
【化学——选修2:化学与技术】)
(1)粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO2-4等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______ ________(填序号)
(2)工业生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”);
(3)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦碳在高温的氮气流中,通过以下反应制得:
SiO2 + C + N2 = Si3N4 + CO)
①配平上述反应的化学方程式
②该反应的平衡常数表达式为K= 。
(4)水是一种重要的自然资源,天然水在净化处理过程中加入的混凝剂可以是 _ _ (填两种物质名称),其净水作用的原理是 .
如图装置中,容器甲内充入0.1 mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的9/ 10,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的磨擦)

已知: 2Na2O2 + 2CO2= 2Na2CO3 + O2
(1)已知当活塞移至C处时,干燥管中物质的质量增加了2.24 g。
①此时,通入标准状况下的CO2气体 L ,容器甲中NO2转化为N2O4的转化率是
②活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处.则a值必 0.01(填大于、小于、等于),其理由是
(2)若改变干燥管中Na2O2的量,要通过调节甲容器的温度及通入的量CO2,使活塞发生从D到C,又从C到D的移动,则Na2O2的质量最小值应大于________g。
氨是最重要的氮肥,是产量最大的化工品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4KJ/mol.他因此获得了1918年诺贝尔化学奖。在密闭容器中,使2molN2和6molH2混合发生下列反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4KJ/mol.他因此获得了1918年诺贝尔化学奖。在密闭容器中,使2molN2和6molH2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时, N2和H2的转化率比是 。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 ,密度 。(填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度 (填“大于”“小于”或 “等于”)原来的2倍。