下列可以证明H2(g)+I2(g) 2HI(g)已达平衡状态的是 。
2HI(g)已达平衡状态的是 。
①单位时间内生成n mol H2的同时,生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③百分含量w(HI)=w(I2)
④反应速率v(H2)=v(I2)=v(HI)
⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1
⑥温度和体积一定时,生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
| t/℃ |
700 |
800 |
830 |
1 000 |
1 200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是 。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
高炉炼铁中发生的基本反应之一如下:
FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0,其平衡常数表达式为K= ,又知1 100 ℃时,K=0.28。
Fe(s)+CO2(g) ΔH>0,其平衡常数表达式为K= ,又知1 100 ℃时,K=0.28。
(1)温度升高,化学平衡移动后达到新的平衡,平衡常数 。(填“变大”“变小”或“不变”)
(2)1 100 ℃时测得高炉中c(CO2)=0.013 mol·L-1,c(CO)=0.05 mol·L-1,在这种情况下,该反应是否处于化学平衡状态: (填“是”或“否”),此时,化学反应速率是v(正) v(逆)(填“大于”“小于”或“等于”),其原因 。
(1)硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一。
2SO2(气)+ O2 (气) 2SO3(气)△H<0。
2SO3(气)△H<0。
根据化学平衡原理来确定的条件或措施有 (填序号)。
A 为提高SO2的转化率,加入过量的空气
B 含SO2的炉气在进行氧化反应以前必须净化,其目的就是为了除尘、以防催化剂中毒
C 使用作V2O5催化剂
D.反应条件不使用很高温度
E.氧化反应在常压下进行
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系
如下图所示。根据图示回答下列问题:
①将2 mol SO2和1 mol O2置于10L密闭容器中,反应达到平衡后,体系的总压为0.10MpPa,该反应的平衡常数为 。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(3)若实验室在催化剂存在的条件下,向某密闭容器中充入1.6molSO2和0.8molO2,此时容器体积为100L,在温度和压强不变条件下反应达到平衡,SO3体积分数为0.50,SO2的转化率为α。
①达平衡时混合气体的体积为_________,α为_________;
②若保持温度和压强不变,平衡时再充入1 molSO3,则平衡时SO2体积分数为 ;
③若起始时充入x mol SO2、y molO2和z mol SO3,在,反应达平衡时,测得混合气体的体积为120 L,SO3体积分数仍为0.5。则x、 y应满足的关系式为 ,x、z应满足的关系式为 。
④在同样的温度下,若条件为恒温恒容(100L),在此容器中加入1.6molSO2和0.8molO2到达平衡时,SO2的转化率_______α(填“大于”、“小于”或“等于”)
(4)硫酸工业的尾气中含有少量的SO2,常用氨水吸收后在加硫酸,回收SO2同时得到化肥硫酸铵,硫酸铵溶液中各离子物质的量浓度由大到小的顺序为 。
(8分)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。请回答下列问题:
(1)已知: ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+49.0kJ/mol
②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H=-192.9kJ/mol
由上述方程式可知,CH3OH(g)的燃烧热____(填“大于”、“等于”或小于”)192.9kJ/mol。已知水的气化热为44 kJ/mol,则表示氢气燃烧热的热化学方程式为______________________________。
(2)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考查温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃)
该反应为_________反应(填“放热”或“吸热”);在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为____________________。
(6分)如图所示,容器A左侧是可平行移动的活塞。向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL。在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)  Z(g)+2W(g),达到平衡时V(A)=1.2aL。试回答:
Z(g)+2W(g),达到平衡时V(A)=1.2aL。试回答:
(1)A中X的转化率为 。
(2)A、B中X转化率大小关系为A B(填“>”、“<”、“="”" )
(3)打开K,一段时间后又达到新的平衡时,A的体积为 L(连通管中气体体积不计)
Ⅰ、向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol·L -1HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。(已知:Cu2O+2H+=Cu+Cu2++H2O)
(1)Cu2O跟稀硝酸反应的离子方程式 。
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 g。
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 。
Ⅱ、一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2,发生反应:2SO2(g)+O2(g)  2SO3(g)。当反应达到平衡时,容器内压强变为起始时的0.7倍。
2SO3(g)。当反应达到平衡时,容器内压强变为起始时的0.7倍。
请回答下列问题:
(4)判断该反应达到化学平衡状态的标志是 (填字母)。
| A.SO2、O2、SO3三者的浓度之比为2∶1∶2 | B.容器内气体的压强不变 |
| C.容器内混合气体的密度保持不变 | D.SO3的物质的量不再变化 |
E.SO2的生成速率和SO3的生成速率相等
(5) SO2的转化率 。
对可逆反应aA(g)+bB(g) cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系:
cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系: =K(为一常数),K称为化学平衡常数,其反应的K值只与温度有关。现有反应:CO(g)+H2O(g)
=K(为一常数),K称为化学平衡常数,其反应的K值只与温度有关。现有反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-Q kJ·mol-1。在850℃时,K=1。
CO2(g)+H2(g) ΔH=-Q kJ·mol-1。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K 1(填“大于”“小于”或“等于”)。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:①当x=5.0时,上述平衡向 (填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
(3)在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a b(填“大于”“小于”或“等于”)。
(共12分)在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.01 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)800 ℃,反应达到平衡时,NO的物质的量浓度是________;升高温度,NO的浓度增大,则该反应是________(填“放热”或“吸热”)反应。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
已知2SO2(g)十O2(g)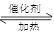 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。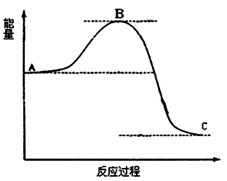
请回答下列问题:
(1)1mol SO2(g)氧化为1mol SO3(g)放出的热量为99.00kJ·mol-1,写出该反应的热化学方程式 。
(2)①在图中标出该反应的活化能E和反应热△H;
②该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低,请在图中画图表示出来,并进行必要的标注。
(3)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是 。
| A.容器中气体总压强不变 | B.容器中混合气体的密度不变 |
| C.每生成1mol SO3的同时生成1molSO2 | D.SO2、O2、SO3的物质的量之比为2∶1∶2 |
(4)在400℃,常压下,向体积为2L的密闭容器中充入2mol SO2(g)和1.92mol O2(g),充分反应后,测得还有0.08mol SO2剩余,求该反应的平衡常数(要求写出计算过程)。
(10分) Ⅰ研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ∆H < 0 (II)
2ClNO(g) K2 ∆H < 0 (II)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。若要使K2减小,可采用的措施是 。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x= 。
2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霆形成的原因。
(1)汽车尾气净化的主要原理为;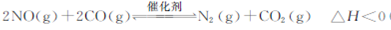 , 在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态。
, 在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态。
①能判断该反应达到平衡状态的标志是 。
| A.在单位时间内生成1molCO2的同时消耗了lmolCO |
| B.混合气体的密度不再改变 |
| C.混合气体的平均相对分子质量不再改变 |
| D.混合气体的压强不再变化 |
②在t2时刻,将容器的容积迅速扩大到原来的2倍, 在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在右图中补充画出从t2 到t4时刻正反应速率随时间的变化曲线: 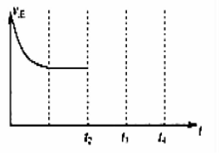
(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应为: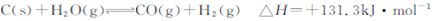
①该反应在 下能自发进行(填“高温”或“低温”)。
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为 。(已知: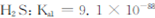 ;
;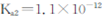 。
。 ;
; 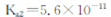 。)
。)
(3)已知反应: ,现将不同量的CO(g)和H20(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
,现将不同量的CO(g)和H20(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据: 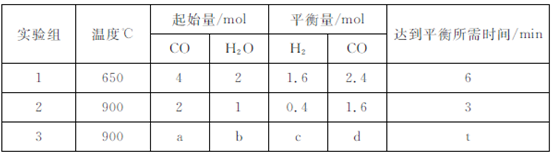
①实验1条件下平衡常数K= (保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是 。
③该反应的 0(填“<”或“>”);
0(填“<”或“>”);
利用“化学蒸气转移法”制备TaS2晶体,某温度下的2L恒容密闭容器中加入一定量 的 I2(g)和TaS2(s)发生如下反应
TaS2(s)+2I2(g) TaI4(g)+S2(g)△H=a kJ·mol-1 (I)
TaI4(g)+S2(g)△H=a kJ·mol-1 (I)
达平衡时,TaS2(s)、I2(g)、TaI4(g)、、S2(g)的物质的量分别为3 mol 、2mol、2mol、2mol。
(1)反应(I)的平衡常数表达式K=
(2)若该温度下该容器中某时刻TaS2(s)、I2(g)、TaI4(g)、、S2(g)的物质的量分别为2mol、2mol、4mol、4mol,则该时刻平衡向 (填“正反应”或“逆反应”)移动,v正 v逆(填“>”、“=”或“<”)。
(3)在不同温度下,该反应的平衡常数K如下表:
| 温度/℃ |
40 |
80 |
200 |
| 平衡常数K |
1 |
1.5 |
4 |
该反应的△H 0(填“>”、“=”或“<”)。
(4)40℃时,向该恒容密闭容器中加入2mol I2(g)和4mol TaS2(s),I2(g)的平衡转化率为 (写出计算过程,结果保留小数点后1位)
工业上也可以用CO2和H2反应制得甲醇。在2×105Pa、300℃的条件下,若有44g CO2与6g H2恰好完全反应生成气体甲醇和水,放出49.5kJ的热量。试写出该反应的热化学方程式: 。
某次实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
试回答下列问题:
(1)a点正反应速率 (填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是 ,最小的是 。
| A.0~1min |
| B.1~3min |
| C.3~8min |
| D.8~11min |
(3)计算该实验平衡时氢气的转化率和该条件下反应的平衡常数K(写出计算过程)。
(4)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线II对应的实验条件改变是 。
(1)制备氢氧化铁胶体的化学方程式为 。
(2)碳酸氢钠在水溶液中的电离方程式为 。
(3)能证明Na2SO3溶液中存在SO32-+H2O HSO3-+OH-水解平衡的事实是 (填选项字母)。
HSO3-+OH-水解平衡的事实是 (填选项字母)。
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色退去
B.滴入酚酞溶液变红,再加入氯水后红色退去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
(4)现有可逆反应:2A(g)+2B(g) C(g)+3D(s),在密闭容器的容积、温度都相同的条件下,分别从以下两条途径建立平衡:Ⅰ. A、B的起始物质的量均为2 mol,Ⅱ.C、D的起始物质的量分别为2 mol和6 mol。以下说法中正确的是 (填选项字母)。
C(g)+3D(s),在密闭容器的容积、温度都相同的条件下,分别从以下两条途径建立平衡:Ⅰ. A、B的起始物质的量均为2 mol,Ⅱ.C、D的起始物质的量分别为2 mol和6 mol。以下说法中正确的是 (填选项字母)。
A.Ⅰ、Ⅱ两条途径最终达到平衡时,体系内混合气体的百分组成相同
B.达到平衡时,途径Ⅱ所得混合气密度为途径Ⅰ所得混合气密度的2倍
C.达到平衡时,途径ⅡC的平衡浓度大于途径ⅠC的平衡浓度的2倍
(5)在恒容绝热(不与外界交换能量)条件下进行2A (g)+ B(g) 2C(g)+ D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系: 。
2C(g)+ D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系: 。
| 物质 |
A |
B |
C |
D |
| 起始投料/mol |
2 |
1 |
2 |
0 |