广东省广州市海珠区高三8月摸底考试理综化学试卷
化学与生活密切相关,下列说法正确的是
| A.福尔马林可用于保存海鲜产品 |
| B.鸡蛋清中加入CuSO4溶液会发生变性 |
| C.合成橡胶与光导纤维都属于有机高分子材料 |
| D.丝绸和棉花的组成元素相同,分子结构不同,因而性质不同 |
NA代表阿伏加德罗常数的数值,下列说法正确的是(C-12 H-1)
| A.4.0g CH4中含有共价键的数目为NA |
| B.标准状况下,22.4L氨水含有NA个NH3分子 |
| C.常温下,0.1mol/L NH4NO3溶液中NO3-的数目为0.1NA |
| D.标准状况下,2.24L Cl2通入足量NaOH溶液中,反应转移电子的数目为0.2NA |
下列说法不正确的是
| A.单质Si能与NaOH溶液反应 |
| B.向氯化铝溶液中滴加过量氢氧化钠可制得Al(OH)3 |
| C.在反应:4CuS + 5O2 = 2Cu2O + 4SO2中,CuS既是氧化剂又是还原剂 |
| D.向AgCl的饱和液中加少量KI溶液可以比较AgCl和AgI的溶解度大小 |
水溶液中能大量共存的一组离子是
| A.K+、Ca2+、Cl-、SO42- | B.Fe2+、H+、CO32-、ClO- |
| C.Mg2+、NH4+、Cl-、SO42- | D.H+、Fe3+、NO3-、SCN- |
下列叙述正确的是
| A.氢氧燃料电池中O2通入负极 |
| B.铅蓄电池在放电时,其负极的电极反应为:Pb-2e=Pb2+ |
| C.碱性锌锰电池在工作时,电解质中的OH-移向正极 |
| D.在海轮外壳镶嵌锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 |
X |
Y |
Z |
M |
N |
R |
Q |
|
| 原子半径(×10-10 m) |
1.86 |
0.99 |
1.43 |
1.60 |
1.02 |
0.75 |
0.74 |
|
| 主要化合价 |
最高正价 |
+1 |
+7 |
+3 |
+2 |
+6 |
+5 |
—— |
| 最低负价 |
—— |
-1 |
—— |
—— |
-2 |
-3 |
-2 |
下列说法正确的是
A.气态氢化物的稳定性:N > Y
B.元素X和Q形成的化合物中不可能含有共价键
C.M(OH)2的碱性比XOH的碱性强
D.X、Z、R的最高价氧化物对应的水化物之间可两两相互反应
下列实验中,依据实验操作及现象,得出的结论正确的是
| |
操 作 |
现 象 |
结 论 |
| A |
测定等浓度的Na2CO3和Na2SO4 溶液的pH |
前者pH比后者的大 |
非金属性: |
| B |
将一片铝箔置于酒精灯外焰上灼烧 |
铝箔熔化但不滴落 |
铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
| C |
向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 |
生成白色沉淀 |
溶液X中一定含有 或 或 |
| D |
取久置的Na2O2粉末,向其中滴加过量的盐酸 |
产生无色气体 |
Na2O2没有变质 |
已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是
| A.混合溶液PH<7 |
| B.对混合溶液进行微热,K1增大、K2减小 |
| C.调节混合溶液的PH值至中性,则此时溶液中c(Na+)=c(CH3COO—) |
| D.温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO—)减小 |
已知化合物Ⅰ  和化合物Ⅱ
和化合物Ⅱ 在一定条件下发生反应能生成化合物III
在一定条件下发生反应能生成化合物III  ,请回答以下问题。
,请回答以下问题。
(1)物质Ⅰ的化学式为 ;
(2)下列对物质Ⅱ的说法正确的是 ;
| A.能发生加成反应 | B.具有5种不同化学环境的氢原子 |
| C.能与NaHCO3溶液反应生成CO2 | D.能与新制Cu(OH)2反应生成红色沉淀Cu2O |
(3)写出化合物II符合下列条件的任意两种同分异构体 , ;
①苯环上只有一个取代基 ②含有酯基
(4)写出物质III发生加聚反应的化学方程式 ;
(5)物质 在一定条件下能发生类似化合物I和化合物II生成化合物III的反应,请写出类似化合物III的生成物的结构简式 。
在一定条件下能发生类似化合物I和化合物II生成化合物III的反应,请写出类似化合物III的生成物的结构简式 。
已知2SO2(g)十O2(g)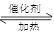 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。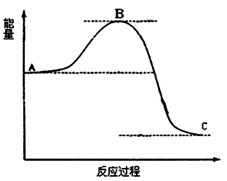
请回答下列问题:
(1)1mol SO2(g)氧化为1mol SO3(g)放出的热量为99.00kJ·mol-1,写出该反应的热化学方程式 。
(2)①在图中标出该反应的活化能E和反应热△H;
②该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低,请在图中画图表示出来,并进行必要的标注。
(3)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是 。
| A.容器中气体总压强不变 | B.容器中混合气体的密度不变 |
| C.每生成1mol SO3的同时生成1molSO2 | D.SO2、O2、SO3的物质的量之比为2∶1∶2 |
(4)在400℃,常压下,向体积为2L的密闭容器中充入2mol SO2(g)和1.92mol O2(g),充分反应后,测得还有0.08mol SO2剩余,求该反应的平衡常数(要求写出计算过程)。
二氧化钛(TiO2)又称钛白,工业上利用钛铁矿(主要成分FeTiO3,其中铁为正二价)为原料,采用硫酸法制得,其工艺流程如下图所示
请回答:
(1)铁矿加入硫酸反应可制得硫酸氧钛,其反应的化学方程式为:
FeTiO3+ 2H2SO4=( )TiOSO4+( )+( );
(2)为了提高二氧化钛的纯度,需要除去浸出液中的Fe3+,则加入的试剂A为 ,需过量的原因是 。
(3)操作1是 。
(4)进行操作1时需将滤液1在70-75℃,压力8000Pa的条件下真空蒸发器中进行,其原因是为了防止 ,滤液2加水稀释使硫酸氧钛(TiOSO4)水解生成偏钛酸(TiO2·nH2O),请写出该水解反应的化学方程式 。
氯元素(Cl)是最重要的“成盐元素”,主要以NaCl的形式存在于海水和陆地的盐矿中。食盐不仅是人体必需的物质,而且是重要的化工原料,从海水中提取氯并应用于工农业生产中的图示如下。
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质、精制后可得饱和NaCl溶液。精制时通常在溶液中依次加入的试剂及操作正确的是 ;
A.过量的BaCl2 过量NaOH
过量NaOH 过量Na2CO3
过量Na2CO3 过滤
过滤 过量HCl
过量HCl
B.过量的NaOH  过量Na2CO3
过量Na2CO3  过量BaCl2
过量BaCl2  过滤
过滤  过量HCl
过量HCl
C.过量的BaCl2 过量Na2CO3
过量Na2CO3 过量NaOH
过量NaOH  过滤
过滤  过量HCl
过量HCl
D.过量的NaOH 过量 BaCl2
过量 BaCl2 过量Na2CO3
过量Na2CO3  过量HCl
过量HCl 过滤
过滤
写出加入盐酸后可能发生的化学反应的离子方程式 。
(2)工业上用电解饱和食盐水的方法制取烧碱和氢气、氯气。下图是电解饱和食盐水装置的一部分,请将装置补充完整,并标出阴阳极和通电时溶液中离子移动的方向。
阴极反应式为 ;反应类型 (填氧化或还原反应),
总电极反应式为 。
(3)在实验室中用浓盐酸与MnO2共热可制取Cl2。
① 下列收集Cl2的装置正确的是 ;
②检验是否有氯气生成可采用的方法是 ;
A.用干燥的蓝色石蕊试纸 B.用干燥的有色布条
C.用湿润的淀粉碘化钾试纸 D.将气体通入硝酸银溶液
③ 将制得的Cl2与Ca(OH)2充分反应,可制得漂粉精,写出反应的化学方程式 。
④ 如下图所示,往漂粉精溶液中持续通入SO2 的过程中,可观察到的现象有(至少写出两点) 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号