(8分)
痛风是关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:
① HUr(尿酸,aq)  Ur―(尿酸根,aq)+H+(aq) (37℃时,Ka =4.0×10-6)
Ur―(尿酸根,aq)+H+(aq) (37℃时,Ka =4.0×10-6)
② NaUr(s)  Ur―(aq)+Na+(aq)
Ur―(aq)+Na+(aq)
(1)37℃时,1.0L水中可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp为
(2)关节炎发作大都在脚趾和手指的关节处,这说明温度降低时,反应②的Ksp (填“增大”、“减小”或“不变”),生成尿酸钠晶体的反应是 (填“放热”或“吸热”)反应。
(3)37℃时,某病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3mol/L,其中尿酸分子的浓度为5.0×10-4mol/L,该病人尿液的c(H+)为 mol/L。
(8分)在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g)  2NO2(g)(正反应为放热反应)体系中,n(NO)随时间的变化如下表:
2NO2(g)(正反应为放热反应)体系中,n(NO)随时间的变化如下表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)如图中表示NO2变化曲线的是 。用O2表示从0 s~2 内该反应的平均速率v= mol/(L·s)。
(2)能说明该反应已达到平衡状态的是 .
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v(NO)逆=2v(O2)正 d.容器内密度保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
分一定温度下,在容积为VL的密闭容器中进行反应:aN(g) bM(g),N、M的物质的量随时间的变化曲线如图所示:
bM(g),N、M的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中 =________。
=________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为_________。
(3)下列叙述中能说明上述反应达到平衡状态的是________。
A 反应中M与N的物质的量之比为1:1
B 混合气体的总质量不随时间的变化而变化
C 混合气体的总物质的量不随时间的变化而变化
D 单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数随温度的变化如下表:
CO2(g)+H2(g)的平衡常数随温度的变化如下表:
| T/℃ |
700 |
800 |
850 |
1 000 |
1 200 |
| K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
请回答下列同题:
(1)该反应的化学平衡常数表达式K = 。
(2)上述正反应是________反应(填“放热”或“吸热”)。
(3)能判断该反应已经达到化学平衡状态的是____。
A.容器中压强不变 B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(5)已知在一定温度下:
C(s)+CO2(g)  2CO(g) 平衡常数K1;
2CO(g) 平衡常数K1;
C(s)+H2O(g)  CO(g)+H2(g) 平衡常数K2;
CO(g)+H2(g) 平衡常数K2;
CO(g)+H2O(g)  H2(g)+CO2(g) 平衡常数K;
H2(g)+CO2(g) 平衡常数K;
则K1、K2 、K之间的关系是________。
向2L密闭容器中通入amol 气体A和bmol气体B,在一定条件下发生反应: xA(g)+yB(g)  pC(g)+qD(g)已知:平均反应速率VC=VA/2;反应2min 时,A的浓度减少了1/3,B的物质的量减少了a/2mol,有a mol D生成。回答下列问题:
pC(g)+qD(g)已知:平均反应速率VC=VA/2;反应2min 时,A的浓度减少了1/3,B的物质的量减少了a/2mol,有a mol D生成。回答下列问题:
(1)反应2min内,VA = ;
(2)化学方程式中,x= 、y= 、p= 、q= ;
(3)如果其他条件不变,将容器的容积变为 1L,进行同样的实验,则与上述反应比较:
①反应速率 (填“增大”、“减小”或“不变”)
②平衡时反应物的转化率 (填“增大”、“减小”或“不变”),理由 是 ;
(8分)反应mA+nB pC在某温度下达到平衡。
pC在某温度下达到平衡。
(1)若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是________。
(2)若A为液体,C为气体,且m+n=p,在加压时化学平衡发生移动,则平衡必定向________(填“正反应”或“逆反应”)方向移动。
(3)如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为________态。
(4)若升高温度,A物质的转化率增大,则该反应为________(填“吸热”或“放热”)反应。
(10分) 反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
(1)该反应是____________(填“吸热”或“放热”)反应。
(2)当反应达到平衡时,升高温度,A的转化率________(填“增大”“减小”或“不变”),原因是_____。
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1________,E2________(填“增大”“减小”或“不变”)。
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式 。
(2)反应开始至2min,以气体Z表示的平均反应速率为 。
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的 倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时_______(填“增大”“减小”或“相等”)。
某可逆反应从0—2分钟进行过程中, 在不同反应时 间各物质的量的变化情况如下图所示。则该反应的的反应物是 ,生成物是 ,化学方程式为 ;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为 _____ ,若不能,则其原因为 _ ________________ ;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 ____ 状态。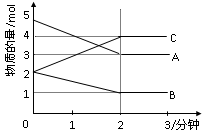
(6分) 在一定温度下,将4mol SO2与2molO2放入4L的密闭容器中,在一定条件下反应,10分钟时达到平衡: 2SO2 + O2 2SO3 测得平衡时混合物总物质的量为5mol,求:
2SO3 测得平衡时混合物总物质的量为5mol,求:
(1)10分钟时O2的反应速率为 mol/(L·min)(2)平衡时SO2的转化率
(3) 平衡常数K为多少
在固定容积的密闭容器中,有可逆反应nA(g)+mB(g) pC(g)处于平衡状态(已知n+m>p,△H>0)。升高温度时c(B)/c(C)的比值 ,混合气体的密度 ;降温时,混合气体的平均相对分子质量 ;加入催化剂,气体的总物质的量 ;充入C,则A、B的物质的量 。(填增大、减小、不变、不确定)
pC(g)处于平衡状态(已知n+m>p,△H>0)。升高温度时c(B)/c(C)的比值 ,混合气体的密度 ;降温时,混合气体的平均相对分子质量 ;加入催化剂,气体的总物质的量 ;充入C,则A、B的物质的量 。(填增大、减小、不变、不确定)
(6分)一定温度下,在容积为VL的密闭容器里进行反应:aN(g) bM(g),M.N的物质的量随时间的变化曲线如图所示:
bM(g),M.N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中a∶b = 。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为: 。
(3)下列叙述能说明上述反应达到平衡状态的是(填序号) 。
A反应中M与N的物质的量之比为1:1
B混合气体的总质量不随时间的变化而变化
C混合气体的总物质的量不随时间的变化而变化
D单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
在容积相同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2(g)+3H2(g)  2NH3(g),并分别在t秒时测定其中NH3的体积分数,绘图如右:
2NH3(g),并分别在t秒时测定其中NH3的体积分数,绘图如右:
(1)A、B、C、D、E五点中,尚未达到化学平衡状态的点是________。
(2)此可逆反应的正反应是________反应。(填“放热”或“吸热”)。
(3)AC段的曲线是增函数,CE段曲线是减函数,试从反应速率和平衡角度说明理由:_____________________________________________________。
(6分)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别
为A、B,如图所示。
(1)据图判断该反应是 (填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率_____(选填“增大”、“减小”、“不变”)。
(2)其中B历程表明此反应采用的条件为 (选填下列标号字母),
A. 升高温度 B.增大反应物的浓度 C.降低温度 D.使用了催化剂
作出正确判断的理由为 。
(3)若△H的数值为200 kJ/mol,则此反应在A反应历程中的正反应的活化能为 kJ/mol;x= kJ/mol
(1)在一个恒温恒容的密闭容器中,可逆反应N2(g)+3H2(g) 2NH3(g) △H<0达到平衡的标志是__________________________(填编号)
2NH3(g) △H<0达到平衡的标志是__________________________(填编号)
①反应速率v(N2):v(H2):v(NH3) =" 1" : 3 : 2 ②各组分的物质的量浓度不再改变
③体系的压强不再发生变化 ④混合气体的密度不变
⑤单位时间内生成n mol N2的同时,生成3n mol H2
⑥2V(N2正)= V(NH3逆)
⑦单位时间内3 mol H—H键断裂的同时2 mol N—H键也断裂
⑧混合气体的平均相对分子质量不再改变
(2)向某体积固定的密闭容器中加入0.3molA、0.1molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如下图所示。已知在反应过程中混合气体的平均分子量没有变化。请回答:
①密闭容器的体积是 L。
②若t1=15s时,则t0-t1阶段以C物质浓度变化表示的反应速率为v(C)= 。
③写出反应的化学方程式: 。
④B的起始物质的量是 。
(3)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式: 。若1g水蒸气转化为液态水放热2.44kJ,则反应2H2(g)+O2(g) =2H2O(l) △H= kJ∙mol-1。