(8分)某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得: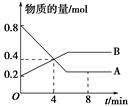
(1)该反应的化学方程式为____________________________________。
(2)反应开始至4 min时,A的平均反应速率为____________________________。
(3)4 min时,反应是否达到平衡状态?________(填“是”或“否”), 8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
相关知识点
 O2(g)
O2(g) SO3(g) △H=﹣98kJ·mol﹣1。
SO3(g) △H=﹣98kJ·mol﹣1。

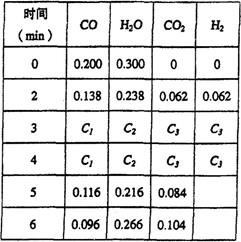
 CO2(g)+H2(g) △H<0 CO和H2O浓度变化如图,
CO2(g)+H2(g) △H<0 CO和H2O浓度变化如图,



 Mg(OH)2+
Mg(OH)2+  MgCl2+mH2O水热处理后,过滤、水洗。水洗的目的是___________。
MgCl2+mH2O水热处理后,过滤、水洗。水洗的目的是___________。 H2O(g) △H2="+87.7" kJ·mol﹣1
H2O(g) △H2="+87.7" kJ·mol﹣1 粤公网安备 44130202000953号
粤公网安备 44130202000953号