按要求填空:
(1)写出制取氢氧化铁胶体的水解方程式:
(2)有4中混合溶液,分别由等体积0.1mol/L的2种溶液混合而成:①CH3COONa与HCl②CH3COONa与NaOH③CH3COONa与NaCl④CH3COONa与NaHCO3,则c(CH3COO-)从大到小的关系为 。(填序号)。
(3)25℃时,已知0.1mol·L-1 CH3COONa溶液的PH=8,精确表达下列算式的数学结果:
①c(Na+)-c(CH3COO-)= ;②c(OH-)-c(CH3COOH)=
(4)若往Mg(OH)2的悬浊液中逐滴滴入NH4Cl溶液至澄清,该过程中沉淀溶解的离子反应是 。
I.H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2- 。
H++A2- 。
(1)NaHA溶液显酸性,则溶液中离子浓度的大小顺序为____________________。
(2)常温时,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性。此时该混合溶液的下列关系中,一定正确的是_______________。
A.c(Na+ )>c(K+) B.c(H +)•c(OH)=1×10-14
C.c(Na+ )=c(K+) D.c(Na+ )+c(K+ )=c(HA-)+c(A2- )
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s) Ca2+ (aq)+A2- (aq),滴加少量Na2A固体,c(Ca2+ )_______________(填“增大”、“减小”或“不变”),原因是________________。
Ca2+ (aq)+A2- (aq),滴加少量Na2A固体,c(Ca2+ )_______________(填“增大”、“减小”或“不变”),原因是________________。
Ⅱ.含有Cr2O72-的废水毒性较大,某工厂废水中含4.00×10-3 mol/L的Cr2O72-。为使废水能达标排放,作如下处理:
(1)该废水中加入FeSO4·7H2O和稀硫酸,发生反应的离子方程式为:_______________。
(2)欲使25 L该废水中Cr2O7转化为Cr3+,理论上需要加入__________g FeSO4·7H2O。
(3)若处理后的废水中残留的c(Fe)=1×10-13mol/L,则残留的 Cr3+的浓度为__________。(已知:Ksp[Fe(OH)3]≈1.0×10-38mol/L,Ksp[Cr(OH)3]≈1.0×10-31 mol/L )
氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)室温下,浓度均为0.1mol/L的亚硝酸(HNO2)、次氯酸两种溶液,它们的电离常数Ka分别为:7.1×10﹣4、2.98×10﹣8。将0.1mol/L的亚硝酸稀释,c(H+)将 (填“不变”、“增大”、“减小”);Ka值将(填“不变”、“增大”、“减小”) 。写出涉及HNO2、HClO、NaNO2、NaClO四种物质之间发生的复分解反应的化学方程式 。
(2)羟胺(NH2OH)可看成是氨分子内的l个氢原子被羟基取代的产物,常用作还原剂,其水溶液显弱碱性。已知NH2OH在水溶液中呈弱碱性的原理与NH3在水溶液中相似,请用电离方程式表示其原因 。
(3)磷及部分重要化合物的相互转化如图1所示。
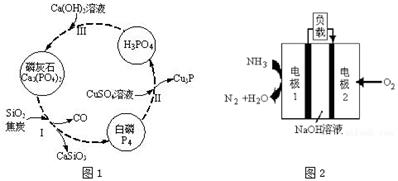
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是 。
②不慎将白磷沾到皮肤上,可用CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为 mol。
(4)若处理后的废水中c(PO43﹣)=4×10﹣7 mol•L﹣1,溶液中c(Ca2+)= mol•L﹣1。(已知Ksp[Ca3(PO4)2]=2×10﹣29)
(5)某液氨﹣液氧燃料电池示意图如图2,该燃料电池的工作效率为50%,现用作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液中NaOH的浓度为0.3mol•L﹣1,则该过程中需要氨气的质量为 g。(假设溶液电解前后体积不变)
(Ⅰ)室温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验 编号 |
HA的物质的量 浓度(mol/L) |
NaOH的物质的 量浓度(mol/L) |
混合后 溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸? 。
(2)乙组混合溶液中c(A-)和c(Na+)的大小关系是
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=________mol/L。
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B===H++HB-HB- H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
(III)已知:25 ℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
(6)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸酸性很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释)_____________。万一误服了少量BaCO3,应尽快用大量0.5 mol/L Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为_____mol/L。
(1)0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合,已知该混合溶液中c(Na+)> c(CN-),用“>、<、=”符号填空
①溶液中c(OH -) c(H +)②c (HCN) c(CN-)
(2)向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再生成二氧化碳气体为止,则在此过程中,溶液的碳酸氢根离子浓度变化趋势可能是:
(A)逐渐减小;(B)逐渐增大;(C)先逐渐增大,而后减小;(D)先逐渐减小,而后增大
(3)pH值相同的HCl(aq)、H2SO4(aq)、CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是 。
②分别用0.1 mol/LNaOH(aq)中和,消耗NaOH(aq)最多的是 。
③反应开始时,反应速率 。
A、HCl最快 B、H2SO4最快 C、CH3COOH最快 D、一样快
(4)某温度下,纯水中的c(H+)= 2.0×10-7 mol/L,则此时c(OH -)= mol/L。相同条件下,测得① NaHCO3(aq)② CH3COONa(aq)③ NaClO(aq)三种稀溶液的pH值相同。它们的物质的量浓度由大到小的顺序是 。
Ⅰ.常温下,如果取0.2mol/LHA溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示):______________________。
(2)混合溶液中由水电离出的c(H+)____0.1mol/LNaOH溶液中由水电离出的c(H+)。(选填“大于”、“小于”或“等于”)
(3)求出混合液中下列算式的精确计算结果(填具体数字):c(Na+)-c(A-)=_________mol/L。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH__________7(选填“大于”、“小于”或“等于”);
Ⅱ.相同条件下,有pH均为4的盐酸、硫酸、醋酸三溶液,其物质的量浓度依次为c1、c2、c3,则c1、c2、c3由大到小顺序为 。
Ⅲ.已知海水中镁离子浓度为1.8×10-3mol/L,且Ksp[Mg(OH)2] =1.8×10-11,常温下要使海水中镁离子产生沉淀,溶液的pH最低应为 。
氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)室温下,0.1mol/L的亚硝酸(HNO2)、次氯酸的电离常数Ka分别为: 7.1× 10-4、 2.98× 10-8。将0.1mol/L的亚硝酸稀释100倍,c(H+)将 (填“不变”、“增大”、“减小”);Ka值将 (填“不变”、“增大”、“减小”)。写出HNO2、HClO、NaNO2、NaClO四种物质之间发生的复分解反应的离子方程式 。
(2)羟胺(NH2OH)可看成是氨分子内的l个氢原子被羟基取代的产物,常用作还原剂,其水溶液显弱碱性。已知NH2OH在水溶液中呈弱碱性的原理与NH3在水溶液中相似,请用电离方程式表示其原因 。
(3)亚硝酸钠与氯化钠都是白色粉末,且都有咸味,但亚硝酸盐都有毒性,通常它们可以通过加入热的白醋鉴别,亚硝酸钠遇到白醋会产生一种红棕色刺激性气味气体和一种无色刺激性气味气体,该反应的离子方程式为 。
(4)磷及部分重要化合物的相互转化如下图所示。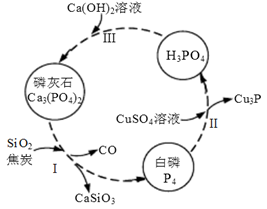
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是 。
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为 。
(5)若处理后的废水中c(PO43-)=4×10-7 mol·L-1,溶液中c(Ca2+)= mol·L-1。(已知Ksp[Ca3(PO4)2]=2×10-29)
(6)某液氨-液氧燃料电池示意图如下,该燃料电池的工作效率为50%,现用作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液中NaOH的浓度为0.3 mol·L-1,则该过程中消耗氨气的质量为 (假设溶液电解前后体积不变)。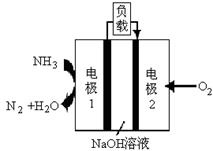
I.下列说法不正确的是 (填字母代码)。
A.对于Al(OH)3(s) Al(OH)3(aq) Al(OH)3(aq) Al3++3OH-,前者为溶解平衡,后者为电离平衡 Al3++3OH-,前者为溶解平衡,后者为电离平衡 |
| B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的 |
| C.能源、信息与材料通常被称为现代社会发展的三大支柱 |
| D.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 |
E.除去硬水中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2溶解度比 MgCO3的小
II.向含有AgI的饱和溶液中:
(1)加入固体AgNO3,则c(I-) (填“变大”、“变小”或“不变”,下同)。
(2)若改加更多的AgI,则c(Ag+) 。
(3)若改加AgCl固体,则c(I-) ,而c(Ag+) 。
III.用“>”、“<”或“=”填空:
(1)25℃时1mol/L FeCl3溶液的pH 80℃时1mol/L FeCl3溶液的pH。
(2)已知NaHSO3溶液中c(HSO3-)>c(SO32-)>c(H2SO3),则溶液中c(H+) c(OH-)。
(3)常温下,取等物质的量浓度的HA溶液与NaOH溶液等体积混合,测得混合溶液的pH=8,混合溶液中由水电离出的c(H+)水 NaOH溶液中由水电离出的c(H+)水。
食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质。已知: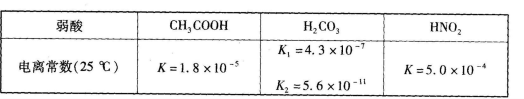
请回答下列问题:
(1)定温度下,向0.1 mol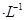 CH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是____(填代号)。
CH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是____(填代号)。
a.溶液的pH增大 b.CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH- ).c(H+)不变
(2)25℃时,0.10 mol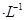 Na2CO3溶液的pH=11,则溶液中由水电离出的c(OH-):_____mol
Na2CO3溶液的pH=11,则溶液中由水电离出的c(OH-):_____mol 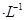 。
。
(3)常温下,将20 mL 0.10 mol 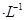 CH3COOH溶液和20 mL 0.10 mol
CH3COOH溶液和20 mL 0.10 mol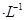 HNO2溶液分别与20 mL 0.10 mol
HNO2溶液分别与20 mL 0.10 mol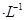 NaHCO3溶液混合(混合后溶液体积变化忽略不计)。
NaHCO3溶液混合(混合后溶液体积变化忽略不计)。
①反应开始时,v(CH3COOH)_________v(HNO2)(填“>”、“<”或“:”),原因是_________.
②充分反应后.两溶液中c(CH3COO-)_________c(NO2-)(填“>”、“<”或“=”)。
(4)25 C时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中
C时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中 =__________。
=__________。
根据下列化合物:①H2SO4,②CH3COOH,③NaCl,④NaOH,⑤NH4Cl,⑥NH3•H2O,⑦CH3COONH4,⑧CH3COONa,⑨NH4HSO4, 请回答下列问题:
(1)常温下,pH=10的CH3COONa 溶液中,水电离出来的c(H+)= ;
(2)已知水存在如下平衡: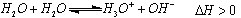 ,现欲使平衡向右移动,
,现欲使平衡向右移动,
且所得溶液显酸性,选择的下列方法是 。
| A.向水中加入NaHSO4固体 | B.向水中加NH4Cl固体 |
| C.加热至100℃ | D.向水中加入NaHCO3固体 |
(3)物质的量浓度相同的①、②、③、④、⑤、⑥六种稀溶液,按pH由大到小的顺序为(填序号) 。
(4)物质的量浓度相同的⑤、⑥、⑦、⑨四种稀溶液中,NH4+浓度由大到小的顺序是(填序号) 。
(5)若浓度均为0.1 mol·L-1、等体积的NaOH和NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则m_______n(填 “<”、“>”或“=”)。
(6)向NaCl和KBr的混合溶液中加入AgNO3溶液,当两种沉淀共存时,c(Br-)/c(Cl-)=_____________________。
(已知Ksp(AgCl) =2.0×10-10,Ksp(AgBr) =5.4×10-13)
(20分)物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡:
(1)有0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为 。
(2)有0.1 mol·L-1的NaHCO3溶液,在该溶液中存在的平衡有三个,请分别用离子方程式表示:
____________________、__________________________、 。
(3)已知25℃时Ksp[Mg(OH)2]=1.2×10-11,KsP[Cu(OH)2]=2.2×10-20。在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,则最先生成的沉淀的离子方程式为
。
(4)NH3·H2O 的电离方程式是 ,往氨水中加入少量醋酸铵固体(提示醋酸铵呈中性),C(OH-) (填“增大”“减小”“不变”)。
(5)已知某温度下K(NH3·H2O)=1.69×10-5,
则该温度下0.1mol/L的氨水中C(OH-)= mol/L
(6)又已知该温度下Ksp〔Mg(OH)2〕=1.2×10-11,
将0.01mol/L的MgCl2溶液与上述氨水等体积混合 (填“有”“无”)沉淀生成。往0.01mol/L的MgCl2溶液中滴加氢氧化钠溶液至pH="10" 此时C(Mg2+)= mol/L。
(10分)已知:乙二酸俗称草酸(结构简式为HOOC—COOH,可简写为H2C2O4)。
5℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;
碳酸(H2CO3)的电离平衡常数为K1=4.5×10-7,K2= 4.7×10-11。
草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。
回答下列问题:
(1)写出水溶液中草酸的电离方程式 ;
(2)相同条件下等物质的量浓度的Na2C2O4溶液的pH比Na2CO3溶液的pH (填“大”、“小”或“相等”);
(3)常温下将0.4 mol/L的KOH溶液20 mL与0.2 mol/L的草酸溶液20 mL混合,则混合后溶液中阴离子浓度的大小顺序为__________________________;
(4)实验室常用酸性高锰酸钾溶液滴定草酸来测定草酸溶液的浓度。高锰酸钾溶液常用 (填“稀硫酸”、“稀硝酸”、“稀盐酸”)酸化,已知酸性高锰酸钾和草酸反应的现象是有气泡产生,紫色消失,其反应的离子方程式为 ;
(5)25℃时向20 mL碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol/L的草酸钾溶液20 mL,
能否产生沉淀 (填“能”或“否”).
(1)常温下,已知0.1 mol·L-1一元酸HA溶液中c(OH-) / c(H+)=1×10-8。
①常温下,0.1 mol·L-1 HA溶液的pH= ;写出该酸(HA)与NaOH溶液反应的离子方程式: ;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是: 。
(2)常温下,向pH=a的氨水中加入等体积盐酸时,溶液呈中性,则此盐酸的pH 14-a(>、<、=)
(3)向物质的量浓度均为0.01 mol·L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的离子是 ,当两种难溶电解质共存时,溶液中c(Ba2+)/c(Mn2+)= 。(此温度下,Ksp(BaCO3)=8.1×10-9、Ksp(MnCO3)=1.8×10-11)
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)草酸是二元弱酸,草酸氢钾溶液呈酸性。在O.1mol·L-1 KHC2O4溶液中,下列关系正确的是____________
A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-)
B.c(HC2O4-)+c(C2O42-) =" 0.1" mol·L-1
C.c(C2O42-) < c(H2C2O4)
D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-)
(2)0.1 mol·L-1的NaHCO3溶液中存在的平衡有(用离子方程式表示)_____________。
(3)MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中不正确的是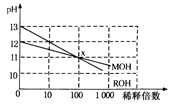
A.ROH是一种强碱
B.在x点,MOH未完全电离
C.在x点,c(M+)=c(R+)
D.稀释前,c(ROH)=10c(MOH)
(4)AgCl在溶液中存在如下平衡: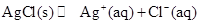 在25℃时,AgCl的
在25℃时,AgCl的
Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3
mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+
浓度由大到小的顺序为_____________(填序号),向50 mL 0.018 mol/L的AgNO3溶液中加
入50 mL 0.02 mol/L的盐酸,沉淀生成后溶液中c(Ag+)是________mol/L。如果向生成沉淀
后的溶液中再加入50 mL 0.001 mol/L的盐酸,是否产生沉淀_______(填“是”或“否”)。
亚铁氰化钾(K4Fe(CN)6 ,黄血盐)在实验室、电镀、食品添加剂及医学上可用于冶疗铊(Tl)中毒、烧制青花瓷时可用于绘画等有广泛用途。已知HCN是一种极弱的酸。现有一种用含NaCN废水合成黄血盐的主要工艺流程如下: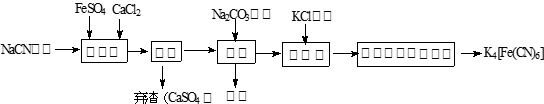
(1)实验室用NaCN固体配制NaCN溶液时,为避免其水解,应先将其溶于 溶液,再用蒸馏水稀释,NaCN水解的离子方程式为_________。
(2)实验室K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6],生成的盐又可用于治疗Tl2SO4中毒,试写出上述检验Fe3+反应的离子方程式为 。
(3)流程图中加入碳酸钠溶液主要目的是 。
(4)相同温度下溶解度:Na4[Fe(CN)6] K4[Fe(CN)6](选填:“>”、“=”、“<”)。
(5)长期火炒添加有亚铁氰化钾的食盐,这时会发生分解反应,试配平下列方程式:3K4Fe(CN)6=□KCN+□Fe3C+□C+□(CN)2↑+□N2↑
(6)电镀银时,电镀液不能直接用硝酸银溶液,可将其转变为K4[Ag2 (CN)6],写出AgCl与黄血盐制取电镀液的离子方程式 。