山东省临沂市高二上学期期末化学试卷
化学与生产、生活密切相关,下列叙述错误的是
| A.用热的纯碱溶液清除灶具上的油污 |
| B.用硫酸清洗锅炉中的水垢 |
| C.用明矾[KAl(SO4)2.12H2O]作净水剂,除去水中悬浮的杂质 |
| D.用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+ |
下列说法正确的是
| A.吸热反应一定不能自发进行 |
B. H大于零的反应是放热反应 H大于零的反应是放热反应 |
C.已知S(单斜,s)=S(正交,s) H<0,则单斜硫比正交硫稳定 H<0,则单斜硫比正交硫稳定 |
| D.应用盖斯定律,可计算某些难以直接测量的反应的反应热 |
下列与金属腐蚀有关的叙述错误的是
| A.生铁的抗腐蚀能力比纯铁弱 |
| B.用锡焊接的铁质器件,焊接处易生锈 |
| C.将钢闸门与直流电源的正极相连可防止其被腐蚀 |
| D.轮船外壳在海水中锈蚀的主要原因是发生吸氧腐蚀 |
下列能说明酸HA为弱电解质的是
| A.HA能与水以任意比互溶 |
B.常温下,0.1 mol HA溶液的pH =2 HA溶液的pH =2 |
| C.HA溶液能与Na2CO3溶液反应,产生CO2气体 |
| D.等体积、等物质的量浓度的HA溶液和NaOH溶液恰好完全反应 |
工业上合成氨的反应为N2(g)+3H2(g) 2NH3(g)△H<0,在其他条件不变的情况下,下列说法正确的是
2NH3(g)△H<0,在其他条件不变的情况下,下列说法正确的是
| A.加入催化剂,逆反应速率不变 |
| B.增大反应体系的压强,正反应速率一定增大 |
| C.升高温度,反应速率加快,反应放出的热量减小 |
| D.若在原电池中进行,反应放出的热量不变 |
以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Au等杂质)的电解精炼,下列说法正确的是
| A.利用阳极泥可回收Ag、Au等金属 |
| B.阳极减少的质量一定等于阴极增加的质量 |
| C.精炼过程中,CuSO4溶液的浓度不发生改变 |
| D.因部分电能转化为热能,精炼时通过的电量与阴极铜的析出量无确定关系 |
下列事实不能用勒夏特列原理解释的是
| A.将氯化铁晶体溶解于浓盐酸中配制氯化铁溶液 |
| B.温度升高,水的电离程度增大 |
| C.氯水中加入碳酸钙,漂白性增强 |
D.反应H2(g)+I2(g) 2HI(g)达平衡后,缩小反应容器体积,混合气体颜色变深 2HI(g)达平衡后,缩小反应容器体积,混合气体颜色变深 |
一定条件下水分解生成氢气和氧气,有关物质和能量的转化关系如图所示,下列判断正确的是
| A.△H1 > △H2 |
| B.△H2 < △H3 |
| C.△H1= △H2+ △H3 |
| D.△H1 + △H3> △H2 |
电解饱和食盐水的装置如图,通电一段时间后,下列说法一定正确的是
| A.滴加适量盐酸,可以使电解质溶液复原 |
| B.在U形管两端分别滴加酚酞试液,右端变红 |
| C.可用中和滴定的方法测定生成的氢氧化钠溶液的物质的量浓度 |
D.若得到22.4 LH2(标准状况下),理论上需要转移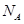 个电子( 个电子(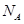 为阿伏加德罗常数的值) 为阿伏加德罗常数的值) |
下列关于0.10 mol NaHSO3溶液的说法正确的是
NaHSO3溶液的说法正确的是
| A.加入NaOH固体,溶液pH减小 |
| B.温度升高,c(HSO3-)增大 |
C.25 C时,加水稀释后,n(H+)与n(OH-)的乘积变大 C时,加水稀释后,n(H+)与n(OH-)的乘积变大 |
| D.NaHSO3的电离方程式为NaHSO3 = Na++H++SO32- |
液态肼(N2H4)-空气燃料电池的装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是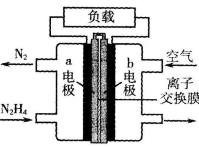
| A.b极发生氧化反应 |
| B.OH-问b极移动 |
| C.放电时,电流从a极经过负载流向b极 |
| D.a极的电极反应式:N2H4+4OH—-4e-=N2↑+4H2O |
常温下,下列各组离子在指定溶液中可能大量共存的是
A. 的溶液中:Na+、CO32-、ClO-、NO3- 的溶液中:Na+、CO32-、ClO-、NO3- |
| B.无色溶液中:Al3+、NH4+ 、Cl-、CO32- |
| C.使甲基橙呈红色的溶液中:K+、Na+、SO42-、CH3COO- |
D.由水电离出的c(H+)=1×10 mol/L的溶液中:Na+、K+、Cl-、HCO3- mol/L的溶液中:Na+、K+、Cl-、HCO3- |
已知:FeCl3(aq)+3KSCN(aq) 3KCl(aq)+ Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是
3KCl(aq)+ Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是
| A.A点与B点相比,A点的c( Fe3+)大 |
| B.反应处于D点时,一定有V (正)<V (逆) |
| C.加入KCl固体可以使溶液由D点变到C点 |
| D.若T1、T2温度下的平衡常数分别为K1、K2,则K1<K2 |
常温下,下列溶液中的离子浓度关系正确的是
| A.pH =3的醋酸溶液中:c(H+)=c(CH3COO-)=3.0mol•L-1 |
| B.Na2S溶液中:c(Na+)>c(HS-)>c(OH-)>c(H2S) |
| C.pH =2的盐酸与pH =12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③ |
某温度下,相同pH值的氨水和氢氧化钠溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示。据图判断正确的是
| A.Ⅱ为氨水稀释时的pH值变化曲线 |
| B.a、b、c三点溶液的导电性:c>b=a |
| C.a、b、c三点溶液中水的电离程度:c=b>a |
| D.用相同浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸的体积:Vb=Vc |
利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g) WI2(g) △H<0
WI2(g) △H<0
(1)该反应的平衡常数表达式K=_________。
(2)在恒温恒容条件下,能够说明上述反应一定达到平衡状态的是_________(填代号)。
a.I2(g)与WI2(g)的浓度相等
b.W的质量不再变化
c.容器内混合气体的密度保持不变
d.容器内混合气体的压强保持不变
(3)在一定温度下,若平衡常数K= ,向2L恒容密闭容器中加入l mol I2(g)和足量W(s),5 min后反应达到平衡。则0-5 min内的平均反应速率v(WI2)=_________,平衡时I2(g)的转化率为_________。相同温度下,若开始加入I2(g)的物质的量是原来的2倍,则下列数值是原来的2倍的是____(填代号)。
,向2L恒容密闭容器中加入l mol I2(g)和足量W(s),5 min后反应达到平衡。则0-5 min内的平均反应速率v(WI2)=_________,平衡时I2(g)的转化率为_________。相同温度下,若开始加入I2(g)的物质的量是原来的2倍,则下列数值是原来的2倍的是____(填代号)。
a.平衡常数 b.达到平衡的时间
c.I2的物质的量浓度 d.平衡时WI2的体积分数
(4)为提高该反应的反应速率,同时使 增大,可采取的措施为 ____________.
增大,可采取的措施为 ____________.
(5)工业上利用上述反应原理提纯金属钨的示意图如下:
反应在石英真空管中进行,先在温度为T2的一端放入未提纯的W粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的晶体,则温度T1_________T2(填“>”‘<”或“=”)。上述反应体系中循环使用的物质是_________.
铜及其化合物在工农业生产及日常生活中应用非常广泛。某研究小组用粗铜(含杂质铁)制备氯化铜晶体(CuCl2.2H2O)的流程如下。
已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
请回答下列问题:
(1)溶液I中加入试剂X可以调节溶液pH,从而除去Fe3+且不引入杂质。
①试剂X可选用下列物质中的__________(填代号)。
a.CuO b.NaOH c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是__________。
(2)由溶液Ⅱ制备CuCl2.2H2O的操作依次为:边滴加浓盐酸边加热浓缩、__________(填操作名称)、过滤、洗涤干燥。
(3)向溶液Ⅱ中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因:__________.
(4)某学习小组用碘量法测定CuCl2.2H2O样品的纯度(杂质不与发生反应)。实验如下:
a.准确称取CuCl2.2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250 mL待测溶液。(已知: )
)
b.移取25. 00 mL待测溶液于锥形瓶中,加几滴指示剂,用c mol Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V mL。 (已知:
Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为V mL。 (已知: )
)
①实验中使用的指示剂名称为____________。
②达到滴定终点时,仰视滴定管读数将使测定结果_________(填“偏高”、“偏低”或“无影响”)。
③该样品中CuCl2.2H2O 的质量分数为_________(用含m、c、V的代数式表示,不用化简)。
食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质。已知: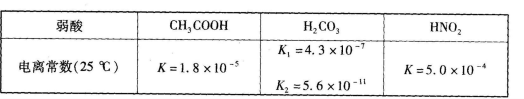
请回答下列问题:
(1)定温度下,向0.1 mol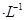 CH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是____(填代号)。
CH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是____(填代号)。
a.溶液的pH增大 b.CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH- ).c(H+)不变
(2)25℃时,0.10 mol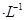 Na2CO3溶液的pH=11,则溶液中由水电离出的c(OH-):_____mol
Na2CO3溶液的pH=11,则溶液中由水电离出的c(OH-):_____mol 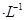 。
。
(3)常温下,将20 mL 0.10 mol 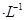 CH3COOH溶液和20 mL 0.10 mol
CH3COOH溶液和20 mL 0.10 mol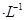 HNO2溶液分别与20 mL 0.10 mol
HNO2溶液分别与20 mL 0.10 mol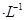 NaHCO3溶液混合(混合后溶液体积变化忽略不计)。
NaHCO3溶液混合(混合后溶液体积变化忽略不计)。
①反应开始时,v(CH3COOH)_________v(HNO2)(填“>”、“<”或“:”),原因是_________.
②充分反应后.两溶液中c(CH3COO-)_________c(NO2-)(填“>”、“<”或“=”)。
(4)25 C时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中
C时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中 =__________。
=__________。
用电化学原理研究金属铝具有重要的意义。
(1)已知:
①工业上利用惰性电极电解熔融的Al2O3冶炼铝,每消耗1000kJ电能时,生成27g铝,则电解过程中能量利用率为____。
③利用Al2O3制备无水AlCl3的反应为
 。反应达平衡时,加入焦炭能使平衡向正反应方向移动,理由是__________.
。反应达平衡时,加入焦炭能使平衡向正反应方向移动,理由是__________.
(2)为了防止钢材腐蚀,常采用电解熔融盐法在钢材表面镀铝。熔融盐中铝元素和氯元素仅以 形式存在。如下图所示:
形式存在。如下图所示:
①钢材表面镀铝时,铝应接电源的________极。
②试分析电镀铝时不用氯化铝水溶液作电解液的原因:_______________.
(3)铝一空气-NaOH溶液组成的铝电池性能优越,可用于电动汽车。写出该电池的负极电极反应式______:
(4)铝可用于处理银器表面的黑斑(Ag2S)。将银器置于铝制容器里的食盐水中并与铝接触,形成原电池,可将Ag2S转化为Ag,该过程中食盐水的作用为_______________.
 2C(g) △H<0,下列图像正确的是
2C(g) △H<0,下列图像正确的是
 粤公网安备 44130202000953号
粤公网安备 44130202000953号