江西省吉安县中高二上学期期中联考化学试卷
下列说法正确的是
| A.放热反应都是自发,吸热反应都非自发 |
| B.熵增反应不一定自发,但自发反应熵一定增大 |
| C.自发反应是不可逆反应 |
| D.判断反应进行的方向,应综合考虑体系的焓变和熵变 |
下列做法与盐的水解无关的是
| A.实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞 |
| B.施肥时,草木灰(有效成分为K2CO3)不能与碳铵混合使用 |
| C.厨房中常用碳酸钠溶液洗涤餐具上的油污 |
| D.配制FeCl2溶液时常常要在溶液中加入少量铁粉 |
恒温恒容,下列物理量不再发生变化时,不能说明反应 A(s)+3B(g) 2C(g)+D(g)已达平衡状态的是
2C(g)+D(g)已达平衡状态的是
| A.混合气体的压强 | B.C的体积分数 |
| C.混合气体的密度 | D.混合气体的平均相对分子质量 |
常温下,若溶液中由水电离产生的c(H+)=1×10-13 mol·L-1,满足此条件的溶液中一定不可以大量共存的离子组是
| A.Na+、Al3+、NO3-、SO42- | B.K+、Na+、Cl-、HCO3- |
| C.K+、Na+、Cl-、S2- | D.K+、NH4+、SO42-、NO3- |
常温下,1体积某浓度的盐酸恰好与10体积pH=11的氢氧化钡溶液完全反应,则该盐酸的物质的量浓度为
| A.0.1mol·L-1 | B.0.01mol·L-1 |
| C.0.2mol·L-1 | D.0.02mol·L-1 |
下列溶液均处于25℃,有关叙述正确的是
| A.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| B.0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.含有NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.pH=4.5的番茄汁中c(H+) 是pH=6.5的牛奶中c(H+)的100倍 |
工业上利用可逆反应 N2(g)+ 3H2(g) 2NH3(g)合成氨,下列叙述正确的是
2NH3(g)合成氨,下列叙述正确的是
| A.该反应是放热反应,降低温度将缩短反应达到平衡的时间 |
| B.恒温恒容下往平衡体系通入氩气,反应体系的压强会增大,反应速率也必定增大 |
| C.恒温恒压下往平衡体系通入氩气,反应体系的体积会增大,平衡体系朝逆向移动 |
| D.合成氨的适宜条件是高温、高压、催化剂,其中催化剂不改变该反应的逆反应速率 |
已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+130kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1。其中H-H和O-H键的键能分别为436 kJ·mol-1和462kJ·mol-1,则O=O键的键能为
| A.496 kJ·mol-1 | B.248 kJ·mol-1 |
| C.428 kJ·mol-1 | D.284 kJ·mol-1 |
25℃时,pH=2的酸和pH=12的碱溶液等体积混合后,恢复至原温,溶液呈酸性。其原因可能是
| A.生成了一种强酸弱碱盐 | B.等浓度的强酸和弱碱溶液反应 |
| C.浓的弱酸溶液和稀的强碱溶液反应 | D.浓的强酸和稀的强碱溶液反应 |
有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg ,室温下实验室用0.01mol·L-1的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如下图所示。
,室温下实验室用0.01mol·L-1的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如下图所示。
下列有关叙述正确的是
| A.A点时加入氢氧化钠溶液体积为20 mL |
| B.OA段溶液中:c(CH3COO-)> c(CH3COOH) |
| C.室温时0.01 mol·L-1的醋酸溶液pH=4 |
| D.若B点时加入NaOH溶液为40 mL,所得溶液中:c(CH3COO-)+ c(CH3COOH) = c(OH-) |
新型NaBH4 / H2O2燃料电池(DBFC)的结构如下图所示(已知硼氢化钠中氢为-1价),有关该电池的说法正确的是
A.放电过程中,Na+从正极区向负极区迁移
B.电极B材料中含MnO2层,MnO2可增强导电性
C.电池负极区的电极反应:BH4-+8OH--8e-=BO2-+6H2O
D.电池反应中,每消耗1 L 6 mol/L H2O2溶液,理论上流过
电路中的电子为6NA个
已知某温度下CH3COOH和NH3•H2O 的电离常数相等。现向10mL浓度为0.1mol•L‾1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,下列说法不正确的是
| A.水的电离程度先增大,后又减小 |
| B.c(CH3COOH)与c(CH3COO‾)之和始终保持不变 |
| C.溶液导电性先增强后减弱 |
| D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO‾) |
将2.0molPCl3和2.0molCl2充入体积不变的1L密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g) PCl5(g) 达到平衡时,PCl5为1.0mol;如果此时将PCl3和Cl2全部移走,在相同温度下再达平衡时PCl5的物质的量是
PCl5(g) 达到平衡时,PCl5为1.0mol;如果此时将PCl3和Cl2全部移走,在相同温度下再达平衡时PCl5的物质的量是
| A.0.38mol | B.0.50mol | C.0.62mol | D.无法确定 |
下列图示与对应叙述相符合的是
A.图I:反应N2+3H 2 2NH3 在恒温情况下,反应速率与压强的关系 2NH3 在恒温情况下,反应速率与压强的关系 |
B.图Ⅱ:反应H2+I2 2HI 达平衡后,升高温度时反应速率随时间的变化 2HI 达平衡后,升高温度时反应速率随时间的变化 |
C.图III:反应CO2(g)+H2(g) CO(g)+H2O(g)ΔH>0,水蒸气含量随时间的变化 CO(g)+H2O(g)ΔH>0,水蒸气含量随时间的变化 |
D.图IV:反应2SO2+O2 2SO3达平衡后,缩小容器体积时各成分的物质的量随时间的变化 2SO3达平衡后,缩小容器体积时各成分的物质的量随时间的变化 |
0.1 mol·L-1Ba(OH)2溶液与0.1 mol·L-1的铵明矾[NH4Al(SO4)2]溶液等体积混合,反应后混合液各离子浓度大小比较合理的是
| A.c(SO42-)>c(NH4+)>c(Al3+)>c(OH-)>c(H+) |
| B.c(NH4+)>c(SO42-)>c(Al3+)>c(OH-)>c(H+) |
| C.c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH- |
| D.c(SO42-)>c(Al3+)>c(NH4+)>c(H+)>c(OH-) |
(8分)按要求填空。
(1)根据常温下氯化铵、氢氧化钡两种晶体混合搅拌反应的现象判断:
该反应△S 0,△H 0 [均填“<”、“>”或“=”, (2)同]
(2)已知:升高温度时,反应2CH4(g)  C2H4(g)+2H2(g)的平衡转化率增大,现有:
C2H4(g)+2H2(g)的平衡转化率增大,现有:
2C(s)+2H2(g)  C2H4(g) ΔH1 ;C(s)+2H2(g)
C2H4(g) ΔH1 ;C(s)+2H2(g)  CH4(g) ΔH2 则ΔH1 2ΔH2
CH4(g) ΔH2 则ΔH1 2ΔH2
(3)在常温常压下测得:C(s)的燃烧热为393 kJ/mol,而1molC(s)燃烧成CO(g)放热110kJ,则CO的燃烧热为
(4)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式:
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表中②的实验目的:
| 编号 |
实验目的 |
碳粉/g |
铁粉/g |
醋酸/% |
| ① |
为以下实验作参照 |
0.5 |
2.0 |
90.0 |
| ② |
|
0.5 |
2.0 |
36.0 |
| ③ |
碳粉质量的影响 |
0.2 |
2.0 |
90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了吸氧腐蚀;此时,碳粉表面发生了 (填“氧化”或“还原”)反应,其电极反应式是: 。
(3)该小组对图中0~t1时压强变大的原因提出如下假设。
请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二: ;
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤及结论: 。
根据下列化合物:①H2SO4,②CH3COOH,③NaCl,④NaOH,⑤NH4Cl,⑥NH3•H2O,⑦CH3COONH4,⑧CH3COONa,⑨NH4HSO4, 请回答下列问题:
(1)常温下,pH=10的CH3COONa 溶液中,水电离出来的c(H+)= ;
(2)已知水存在如下平衡: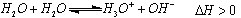 ,现欲使平衡向右移动,
,现欲使平衡向右移动,
且所得溶液显酸性,选择的下列方法是 。
| A.向水中加入NaHSO4固体 | B.向水中加NH4Cl固体 |
| C.加热至100℃ | D.向水中加入NaHCO3固体 |
(3)物质的量浓度相同的①、②、③、④、⑤、⑥六种稀溶液,按pH由大到小的顺序为(填序号) 。
(4)物质的量浓度相同的⑤、⑥、⑦、⑨四种稀溶液中,NH4+浓度由大到小的顺序是(填序号) 。
(5)若浓度均为0.1 mol·L-1、等体积的NaOH和NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则m_______n(填 “<”、“>”或“=”)。
(6)向NaCl和KBr的混合溶液中加入AgNO3溶液,当两种沉淀共存时,c(Br-)/c(Cl-)=_____________________。
(已知Ksp(AgCl) =2.0×10-10,Ksp(AgBr) =5.4×10-13)
(12分)中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g·L-1。某兴趣小组用下图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
(可能用到的相对原子质量:H—1 O—16 S—32) (1)仪器B的名称是 ,水通入A的进口为 。
(1)仪器B的名称是 ,水通入A的进口为 。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,写出该反应的离子方程式: 。
(3)除去C中过量的H2O2,然后用0.0900mol·L-1NaOH标准溶液进行滴定,若滴定终点时溶液的pH=8.8,则选择的指示剂为 ;若滴定的实验操作如下:
①检查滴定管是否漏水
②用标准液润洗盛标准液的滴定管
③装标准溶液并调整液面(记录初读数)
④用蒸馏水洗涤玻璃仪器
⑤把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇至滴定终点,记下滴定管液面刻度。
则滴定操作的正确顺序是(用序号填写)____________________________;
(4)用标准NaOH溶液滴定时,以下操作引起误差偏大的是 。
| A.滴定前仰视,滴定后俯视 |
| B.盛标准液的滴定管用蒸馏水洗后未用标准液润洗 |
| C.颜色改变立即读数 |
| D.盛标准液的滴定管滴前尖嘴部分有气泡,终了无气泡 |
(5)滴定至终点时,消耗NaOH溶液20.00mL,该葡萄酒中SO2含量为 g·L-1
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
CH3OH(g)+H2O(g)实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
①图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是_______(填“吸热”或“放热”)反应;
②从反应开始到第三分钟,氢气的平均反应速率v(H2)= mol·L-1·min-1;
③平衡时CH3OH的体积分数为 。
(2)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1.2molCH3OH(g)和2.4molH2O(g),向B容器中充入1.5molCH3OH(g) 和3.0molH2O(g),两容器分别发生上述(1)中反应的逆反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.4aL,容器B中CH3OH转化率为 ;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为 L。(连通管中气体体积忽略不计,且不考虑温度的影响)
(3)一定条件下的密闭容器中,反应3H2(g) + 3CO(g)  CH3OCH3(g) + CO2(g) ΔH<0 达到平衡时,要提高CO的转化率,可以采取的措施是 (填字母代号)
CH3OCH3(g) + CO2(g) ΔH<0 达到平衡时,要提高CO的转化率,可以采取的措施是 (填字母代号)
A.升温
B.加压
C.增加CO的浓度
D.分离出二甲醚(CH3OCH3)
E.加入催化剂
(4)已知反应2CH3OH(g) CH3OCH3(g)+ H2O(g)在某温度下的平衡常数K=100。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下。下列说法正确的是____________________
CH3OCH3(g)+ H2O(g)在某温度下的平衡常数K=100。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下。下列说法正确的是____________________
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| c/mol L -1 |
0.9 |
0.60 |
0.60 |
A.CH3OH的起始浓度为2.1 mol/L B.平衡时CH3OH的浓度为0.9 mol/L
C.此时正反应速率大于逆反应速率 D.平衡时CH3OH的转化率小于80%




 粤公网安备 44130202000953号
粤公网安备 44130202000953号