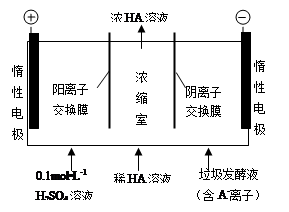
(1)常温下,已知0.1 mol·L-1一元酸HA溶液中c(OH-) / c(H+)=1×10-8。
①常温下,0.1 mol·L-1 HA溶液的pH= ;写出该酸(HA)与NaOH溶液反应的离子方程式: ;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是: 。
(2)常温下,向pH=a的氨水中加入等体积盐酸时,溶液呈中性,则此盐酸的pH 14-a(>、<、=)
(3)向物质的量浓度均为0.01 mol·L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的离子是 ,当两种难溶电解质共存时,溶液中c(Ba2+)/c(Mn2+)= 。(此温度下,Ksp(BaCO3)=8.1×10-9、Ksp(MnCO3)=1.8×10-11)
 2CO2(g)+ N2(g) 。在密闭容器中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如图1所示。据此判断:
2CO2(g)+ N2(g) 。在密闭容器中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如图1所示。据此判断: N2O4(g)ΔH12NO2(g)
N2O4(g)ΔH12NO2(g)

 (3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1 mol/L食盐水的装置,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1 mol/L食盐水的装置,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。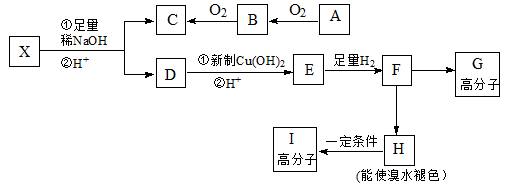
 粤公网安备 44130202000953号
粤公网安备 44130202000953号