北京市房山区高三4月模拟练习化学试卷
下列有关钢铁腐蚀和防护的说法不正确的是
| A.自行车的钢圈上镀一层铬,防止生锈 |
| B.外加直流电源保护钢闸门时,钢闸门与电源的负极相连 |
| C.钢铁发生吸氧腐蚀的正极反应:2H2O +O2+4e-=4OH- |
| D.钢铁发生析氢腐蚀的负极反应:Fe – 3e-=Fe3+ |
戊醇C5H11OH与下列物质发生反应时,所得产物可能结构种数最少(不考虑立体异构)的是
| A.与浓氢溴酸卤代 | B.与浓硫酸共热消去 |
| C.铜催化氧化 | D.与戊酸催化酯化 |
将三种黑色粉末组成的混和物加入到足量的某热浓酸中,充分反应后得到蓝绿色溶液和两种气体。将从蓝绿色溶液中分离得到的盐与0.15mol还原铁粉恰好反应完全,可得浅绿色溶液和6.4g红色沉淀;将上述生成的两种气体通入足量饱和NaHCO3溶液中,仍然收集到两种气体,据此推断黑色粉末可能为
| A.物质的量FeS:CuO:Fe =1:1:1 |
| B.物质的量C:CuO:Fe =3:2:2 |
| C.质量MnO2:CuO:C=5.5:8:12 |
| D.质量Fe:C:CuO=7:5:3 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1mol·L-1 NaHCO3溶液:K+、AlO2—、Cl-、NO3- |
| B.使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Na+ |
| C.c(H+)=1×10-13 mol∙L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- |
| D.遇苯酚变紫色的溶液:Na+、Mg2+、SO42-、Cl- |
能正确表示下列反应的离子方程式是
| A.CuCl2溶液中加入少量氨水:Cu2++2OH-=Cu(OH)2↓ |
| B.向酸性KMnO4溶液中通入SO2:3SO2+2 MnO4-+4OH-=2MnO2↓+3 SO42-+2H2O |
C.电解饱和MgCl2溶液:2Cl-+2H2O 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
| D.向Na2SO3溶液中滴加足量NaClO溶液:SO32- + ClO-= SO42-+ Cl- |
某体积可变的密闭容器,盛有适量A和B的混合气体,在一定条件下发生反应:A+3B 2C。若维持温度和压强不变,当达到限度时容器的体积为V L,其中C气体的体积占10%。下列推断正确的是
2C。若维持温度和压强不变,当达到限度时容器的体积为V L,其中C气体的体积占10%。下列推断正确的是
①原混合气体的体积为1.2V L
②原混合气体的体积为1.1V L
③反应达到限度时气体A消耗掉0.05V L
④反应达限度时气体B消耗掉0.05V L
A.②③ B.②④ C.①③ D.①④
在一定温度不同压强下,可逆反应2X(g)  2Y(g)+Z(g),生成物Z在反应混合物中的体积分数(φ)与反应时间(t)的关系如下图所示,正确的是(已知p1<p2)
2Y(g)+Z(g),生成物Z在反应混合物中的体积分数(φ)与反应时间(t)的关系如下图所示,正确的是(已知p1<p2)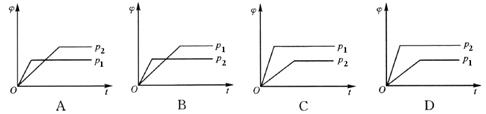
A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置为第___________周期第___________族。
(2)E元素形成的氧化物对应的水化物的化学式为________________。
(3)元素C、D、E形成的离子半径大小关系是________>________>__________(用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程________________________。C、D还可形成化合物D2C2,D2C2含有的化学键是__________________。
(5)由A、B、C三种元素形成的离子化合物的化学式为______________,它与强碱溶液共热,发生反应的离子方程式是____________________。
(6)某一反应体系中含有D2E、D2EC3、D2EC4三种物质,若此反应为分解反应,则此反应的化学方程式为______________________(化学式用具体的元素符号表示)。
利用如图装置测定中和热的实验步骤如下:
①量取50mL 0.25 mol/L硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。
请回答:
(1)NaOH溶液稍过量的原因 。
(2)加入NaOH溶液的正确操作是 (填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是 。
(4)设溶液的密度均为1g/cm3,中和后溶液的比热容c=4.18 J/(g·℃),请根据实验数据写出该反应的热化学方程式 。
(5)若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量 (填“小于”、“等于”或“大于”)57.3 kJ,原因是 。
硼泥主要由MgO和SiO2组成,含有少量Fe2O3、FeO、Al2O3等杂质。用硼泥生产氢氧化镁的工艺流程如下图所示:
已知某些氢氧化物沉淀的pH如下表所示:
| 氢氧化物 |
开始沉淀时的pH |
完全沉淀时的pH |
| Mg(OH)2 |
9.3 |
10.8 |
| Fe(OH)2 |
7.6 |
9.6 |
| Fe(OH)3 Al(OH)3 |
2.7 3.7 |
3.7 4.7 |
(1)MgO的电子式为 。
(2)滤渣2的主要成分是 ,向滤渣2中继续加入过量的NaOH溶液,发生反应的离子方程式为 。
(3)加入NaOH调节溶液pH=12.0时,发生反应的离子方程式为 。
(4)利用Mg(OH)2与含SO2的烟气反应生成MgSO4,可以使烟气脱硫,该反应的化学方程式为 。
(5)若取a吨硼泥为原料,最后得到b吨Mg(OH)2产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为 (用含有a、b的代数式表示)。
氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)室温下,0.1mol/L的亚硝酸(HNO2)、次氯酸的电离常数Ka分别为: 7.1× 10-4、 2.98× 10-8。将0.1mol/L的亚硝酸稀释100倍,c(H+)将 (填“不变”、“增大”、“减小”);Ka值将 (填“不变”、“增大”、“减小”)。写出HNO2、HClO、NaNO2、NaClO四种物质之间发生的复分解反应的离子方程式 。
(2)羟胺(NH2OH)可看成是氨分子内的l个氢原子被羟基取代的产物,常用作还原剂,其水溶液显弱碱性。已知NH2OH在水溶液中呈弱碱性的原理与NH3在水溶液中相似,请用电离方程式表示其原因 。
(3)亚硝酸钠与氯化钠都是白色粉末,且都有咸味,但亚硝酸盐都有毒性,通常它们可以通过加入热的白醋鉴别,亚硝酸钠遇到白醋会产生一种红棕色刺激性气味气体和一种无色刺激性气味气体,该反应的离子方程式为 。
(4)磷及部分重要化合物的相互转化如下图所示。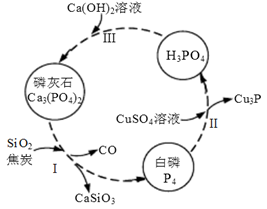
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是 。
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为 。
(5)若处理后的废水中c(PO43-)=4×10-7 mol·L-1,溶液中c(Ca2+)= mol·L-1。(已知Ksp[Ca3(PO4)2]=2×10-29)
(6)某液氨-液氧燃料电池示意图如下,该燃料电池的工作效率为50%,现用作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液中NaOH的浓度为0.3 mol·L-1,则该过程中消耗氨气的质量为 (假设溶液电解前后体积不变)。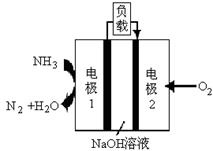
 粤公网安备 44130202000953号
粤公网安备 44130202000953号