向氯酸钠的酸性水溶液中通入SO2,反应中氧化过程为:SO2+2H2O—2e-→SO42-+4H+;
向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,反应中还原过程为:Cl2+2e- →2Cl-。在上述两个反应中均会生成产物X,则X可能是
| A.ClO2 | B.NaClO4 | C.HClO | D.NaClO |
已知M2O2-n离子可与R2-离子作用,R2-被氧化为R单质,在M2O2-n的还原产物中,M为+3价;又如c(M2O2-n-)=0.3mol·L-1的溶液100mL可与c(R2-)="0." 6mol·L-1的溶液150mL恰好完全反应,则n值为
| A.4 | B.5 | C.6 | D.7 |
⑴24 mL 0.05 mol·L-1的Na2SO3溶液恰好被20 mL 0.02 mol·L-1的K2R2O7溶液氧化,则元素R在还原产物中的化合价是________。
⑵将0.64 g Cu全部溶于一定量的浓硝酸中,测得生成气体0.009 mol(含NO、NO2和N2O4),共消耗硝酸0.032 mol。将生成的气体与空气混合,再通入NaOH溶液中,氮氧化物被完全吸收,产物只有NaNO3和H2O。计算空气中参加反应的O2在标准状况下的体积 为________mL。
为________mL。
在bLFeBr2溶液中通入amolCl2时,使溶液中50%的Br-氧化为Br2,则原FeBr2的物质的量浓度为( )
A. mol.L-1 mol.L-1 |
B. mol.L-1 mol.L-1 |
C. mol.L-1 mol.L-1 |
D. mol.L-1 mol.L-1 |
已知下列两个反应:①Fe+H2SO4(稀)====FeSO4+H2↑ ;
②Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。试回答下列问题:
CuSO4+SO2↑+2H2O。试回答下列问题:
⑴反应①中 元素被还原,反应②中 元素被还原。(填元素符号)
⑵当反应①生成2g H2时,消耗H2SO4的质量是 g 。
⑶反应②中生成32g SO2气体时,消耗H2SO4的质量是 g ,其中有 g H2SO4作为氧化剂被还原。
(12分)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法 如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。请回答:
如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。请回答:
(1)软锰矿制备K2MnO4的化学方程式是
;
(2)K2MnO4制备KMnO4的离子方程式是 ;
(3)若用2.5g软锰矿(含MnO280%)进行上述实验,计算KMnO4的理论产量;
(4)KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2,该反应的化学方程式是 ;
(5)上述制得的KMnO4产品0.165g,恰好与0.335g纯Na2C2O4反应完全,计算该KMnO4的纯度。
已知M O
O 离子可与R
离子可与R 离子作用,R
离子作用,R 被氧化为R单质,M
被氧化为R单质,M O
O 的还原产物中,M为+3价;又如c(M
的还原产物中,M为+3价;又如c(M O
O )="0.3" mol·L
)="0.3" mol·L 的溶液100 mL可与c(R
的溶液100 mL可与c(R )="0.6" mol·L
)="0.6" mol·L 的溶液150 mL恰好完全反应,则n值为
的溶液150 mL恰好完全反应,则n值为
| A.4 | B.5 | C.6 | D.7 |
已知,下列反应可以发生:Br2+H2SO3+H2O=2HBr+H2SO4,在100mL含等物质的量HBr和H2SO3的溶液里通入0.01molCl2,有一半Br-变为Br2。原溶液中HBr和H2SO3的浓度都等于
| A.0.0075mol/L | B.0.0018mol/L | C.0.075mol/L | D.0.08mol/L |
取相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是
| A.1∶1∶2 | B.2∶1∶3 | C.6∶3∶2 | D.3∶2∶1 |
已知OCN-中每种元素都满足8电子稳定结构,在反应OCN-+OH-+C12→CO2+N2+C1-+H2O(未配平)中,如果有6 mol C12完全反应,则被氧化的OCN-的物质的量是
| A.2 mol | B.3 mol | C.4 mol | D.6 mol |
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是4FeO42-+10H2O===4Fe(OH)3(胶体)+3O2↑+8OH-,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备:2Fe(OH)3+3ClO-+4OH-===2FeO42-+3Cl-+5H2O;
干法制备:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列有关说法中错误的是( )
| A.高铁酸钾与水反应时,水发生氧化反应 |
| B.干法中每生成1 mol Na2FeO4共转移4 mol电子 |
| C.湿法中每生成1 mol Na2FeO4共转移3 mol电子 |
| D.K2FeO4处理水时,不仅能杀菌,并使悬浮杂质沉降 |
多硫化钠Na2Sx(x>2)在结构上与Na2O2、FeS2、CaC2等有相似之处。Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的 物质的量之比为1︰16,则x的值是 ( )
物质的量之比为1︰16,则x的值是 ( )
| A.5 | B.4 | C.3 | D.2 |
R2O8n-离子在一定条件下可以把Mn2+离子氧化为MnO4-,若反应后R2O8n-离子变为RO42-离子。又知反应中氧化剂与还原剂的物质的量之比为5 ∶2,则n的值是( )
| A.1 | B.2 | C.3 | D.4 |
铁氧磁体法处理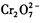 的废水的原理可概述为:向
的废水的原理可概述为:向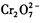 的酸性废水中加人FeSO4·7H2O ,将
的酸性废水中加人FeSO4·7H2O ,将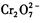 还原为Cr3+,调节溶液的 pH,使溶液中的铁、铬元素转化为组成相当于FeⅡ[FeⅢ XCrⅢ 2-X]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀。处理含 1 mol
还原为Cr3+,调节溶液的 pH,使溶液中的铁、铬元素转化为组成相当于FeⅡ[FeⅢ XCrⅢ 2-X]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀。处理含 1 mol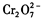 的废水至少需要加人amol FeSO4·7H2O 。下列结论正确的是( )
的废水至少需要加人amol FeSO4·7H2O 。下列结论正确的是( )
| A.x= 0.5 , a= 8 | B.x = 0.5 , a=10 | C.x = 1.5 , a= 8 | D.x = 1.5 , a= 10 |