已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化 Fe3+→Fe2+;MnO4-→Mn2+;Cl2→2Cl-;HNO3→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
| A.Fe3+ | B.MnO4- | C.Cl2 | D.HNO3 |
已知下列两个反应:①Fe+H2SO4(稀)====FeSO4+H2↑;
②Cu+2H2SO4(浓) CuSO4+SO2 ↑ +2H2O。试回答下列问题:
CuSO4+SO2 ↑ +2H2O。试回答下列问题:
(1)反应①中 元素被还原,反应②中 元素被还原。(填元素符号)
(2)当反应①生成2g H2时,消耗H2SO4的质量是 。
(3)反应②中生成32g SO2气体时,消耗H2SO4的质量是 g ,其中有 g H2SO4作为氧化剂被还原。
g ,其中有 g H2SO4作为氧化剂被还原。
5NH4NO3=2HNO3+4N2↑+9H2O中,发生氧化反应与发生还原反应的氮原子个数之比是
| A.1∶3 | B.5∶3 | C.5∶8 | D.5∶4 |
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O +O2+xOH—
+O2+xOH— = Fe3O4+S4O +2H2O,下列说法中,正确的是:
+2H2O,下列说法中,正确的是:
| A.每生成1mol Fe3O4,反应转移的电子总数为3mol | B.Fe2+和S2O 都是还原剂 都是还原剂 |
| C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol | D.x=2 |
酸性条件下,许多氧化剂可使KI溶液中的I-氧化,例如KIO3(IO3-→I2)、H2O2(H2O2→H2O)、FeCl3(Fe3+→Fe2+)、K2Cr2O7(Cr2O72-→Cr3+)。请根据题目要求填空:
(1)写出在醋酸存在的条件下KIO3溶液与KI溶液反应的离子方程式 。
(2)在酸性条件下(足量),各取1 L浓度为1 mol·L-1的KI溶液分别与上述列举四种溶液进行完全反应,则需要溶质的物质的量之比为n(KIO3):n(H2O2):n(FeCl3):n(K2Cr2O7)=" " : : : .(要求写出最简比)
两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42-,若将2.83 g X中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81g I2,反应的离子方程式为:Cr2O72-+I-+H+→Cr3++I2+H2O(未配平) 。若向溶有2.83 g X的溶液中,加入过量的BaCl2溶液,可得到4.66 g白色沉淀.由此可推断出X的化学式为 ( )
A.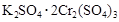 |
B.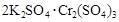 |
C. |
D.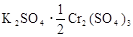 |
氧化还原反应实际上包含氧化和还原两个过程:①向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2 + 2H2O – 2e-→ SO42-+ 4H+;②向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2 + 2e-→ 2Cl-,在①和②反应中均会生成产物X,则X的化学式为 ( )
| A.NaClO | B.HClO | C.ClO2 | D.NaClO4 |
已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4===2CuI↓+13I2+12K2SO4+12H2O,其中1 mol氧化剂在反应中得到的电子为
| A.10 mol | B.11 mol | C.12 mol | D.13 mol |
24mL0.5mol/LNa2SO3溶液,恰好与20 mL 0.2mol/LK2Cr2O7溶液完全反应,则铬元素在还原产物中的化合价为
| A.+6 | B.+3 | C.+2 | D.0 |
R2O8n—离子在一定条件下可以把Mn2+氧化成MnO4-,该反应后R2O8n-离子变为RO42-离子,又知反应中氧化剂与还原剂的物质的量之比为5:2,则n值是
| A. 1 | B. 2 | C. 3 | D. 4 4 |
向含有0.078 mol的FeCl2溶液中通入0.009 mol Cl2,再加入含有0.01 mol X2O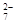 的酸性溶液,使溶液中的Fe2+全部恰好氧化,并使X2O
的酸性溶液,使溶液中的Fe2+全部恰好氧化,并使X2O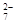 还原为Xn+,则n值为
还原为Xn+,则n值为
| A.5 | B.4 | C.3 | D.2 |
在反应5NH4NO3 ="=" 2HNO3 + 4N2 + 9H2O中,发生氧化反应与发生还原反应的氮原子个数之比是
| A.2:8 | B.5:3 | C.5:8 | D.5:4 |
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:NF3+H2O→NO+HNO3+HF(没配平)。下列有关说法正确的是 ( )
| A.NF3在潮湿的空气中泄漏会产生红棕色气体 |
| B.还原剂与氧化剂的物质的量之比为2∶1 |
| C.若生成0.2 mol HNO3,则转移0.2 mol电子 |
| D.NF3是氧化剂,H2O是还原剂 |
(8分)实验室里迅速制备少量氯气可利用以下反应:
2 KMnO4+16 HCl ="==" 2 KCl + 2 MnCl2 + 5 Cl2↑ + 8 H2O
此反应不需要加热,常温下就可以迅速进行,而且对盐酸的浓度要求不高。
(1)该反应中,氧化剂是__________,还原剂是_________。
(2) 当电子转移的数目为6.02×1023个时生成的氯气的物质的量为  mol
mol
(⑶被氧化的还原剂的物质的量是  mol
mol