[四川]2012届四川省南充高中高三上学期第二次月考化学试卷
设NA表示阿伏加德罗常数的值。下列说法中正确的是
| A.5.6 g Fe和一定量的浓HNO3或稀硝酸完全反应,转移电子均为0.3 NA |
| B.16 g氧气或臭氧的氧原子个数均为NA |
C.1 mol石墨或金刚石中六元环个数均为 |
| D.28.6 g Na2CO3·10H2O在晶体中或溶液中,含有的CO32—离子均小于0.1 NA |
在200 mL 1 mol/L的NaHCO3溶液中,加入一定量的单质或化合物X,恰好使其转化为只含Na2CO3溶质的溶液(不考虑溶质的水解),实现转变的物质X有多种,符合条件的X物质的一组是
| 编号 |
A |
B |
C |
D |
| X的化学式 |
Na |
Na2O |
Na2O2 |
NaOH |
| 加入X的质量(g) |
4.8 |
6.4 |
7.8 |
16.0 |
据最新报道,科学家发现了如下反应:O2+PtF6=O2PtF6,已知O2PtF6是离子化合物,其中阴离子为PtF6-。下列说法正确的是
| A.该离子化合物中1 mol阳离子共有15 mol电子 |
| B.在此反应中O2是氧化剂,PtF6是还原剂 |
| C.每生成O2PtF61mol转移2 mol电子 |
| D.该离子化合物中只含离子键 |
下列有关物质的熔点的比较中,不正确的是
| A.晶体硅<金刚石 | B.K<Na | C.NaCl<NaBr | D.PH3<NH3 |
下列说法中正确的是
| A.元素的非金属性越强,其单质的活泼性一定越强 |
| B.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 |
| C.分子晶体的熔沸点低,常温下均呈液态或气态 |
| D.含有金属阳离子的晶体一定是离子晶体 |
元素X、Y、Z原子序数之和为37,X、Y在同一周期,X+与Z-具有相同电子层结构。下列推测不正确的是
| A.同周期元素中X的金属性最强 |
| B.原子半径X>Y,离子半径X+>Z- |
| C.同族元素中Z的氢化物最稳定 |
| D.同周期元素中Y的最高价含氧酸的酸性最强 |
A、B是短周期第ⅦA族元素,元素A的非金属性比B强,下列说法正确的
A.NaA、NaB的晶体都是离子晶体
B.单质A可把B从NaB的溶液中置换出来
C.HA比HB沸点高的原因是1mol HA分子中H-A键断裂时吸收的能量比1mol HB分子中H-B键断裂时需要吸收的能量多
D.常温下,NaA、NaB溶液的pH均大于7
海洋中有丰富的食品、矿产,能源、药物和水产资源等(如下图所示):
下列有关说法正确的是
| A.第①步中除去粗盐中的SO42—、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
| B.第②步中结晶出的MgCl2·6H2O可在空气中受热分解制无水MgCl2 |
| C.在第③④⑤步中溴元素均被氧化 |
| D.从第③步到第⑤步的目的是为了浓缩 |
向氯酸钠的酸性水溶液中通入SO2,反应中氧化过程为:SO2+2H2O—2e-→SO42-+4H+;
向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,反应中还原过程为:Cl2+2e- →2Cl-。在上述两个反应中均会生成产物X,则X可能是
| A.ClO2 | B.NaClO4 | C.HClO | D.NaClO |
利用右图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。
下列说法中正确的是
| A.氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠 |
| B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 |
| C.电镀工业中,X是待镀金属,Y是镀层金属 |
| D.外加电流的阴极保护法中,X是待保护金属 |
能正确表示下列反应的离子方程式为
| A.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++ H2S↑ |
| B.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O |
| C.将1 mol/L NaAlO2溶液和1.5 mol/L HCl溶液等体积互相均匀混合: 6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ |
| D.NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O=Fe(OH)2↓+2HClO |
某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种。将13.8 g样品加入足量水,样品全部溶解,再加入过量的CaCl2溶液,得到9 g沉淀。下列关于样品所含杂质的判断正确的是
| A.肯定没有KNO3 |
| B.肯定有KNO3,可能还有Na2CO3 |
| C.肯定没有Ba(NO3)2,可能有KNO3 |
| D.肯定没有Na2CO3和 Ba(NO3)2 |
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产 生气体的量随铁粉质量增加的变化如下图所示。
生气体的量随铁粉质量增加的变化如下图所示。
下列说法不正确的是
| A.原混合酸中NO3- 物质的量为0.4 mol |
| B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生H2 |
| C.H2SO4浓度为2.5 mol/L |
| D.第二份溶液中最终溶质为FeSO4 |
向含1 mol HCl和l mol MgSO4的混合溶液中加入1 mol/L的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是
已知:H+(aq)+OH—(aq)=H2O(l);△H1=—57.3 kJ/mol, H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)= Na2SO4(aq)+ H2O(l);△H2=m。下列说法正确的是
Na2SO4(aq)+ H2O(l);△H2=m。下列说法正确的是
| A.上述热化学方程式中的计量数表示分子个数 |
| B.△H1>△H2 |
| C.△H2=—57.3 kJ/mol |
| D.|△H1|>|△H2| |
一定温度下,可逆反应A(s)+2B(g) 2C(g)+D(g);△H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。
2C(g)+D(g);△H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。
下列说法正确的是
| A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 |
| B.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
| C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
| D.保持活塞位置不变,改变温度,达到新的平衡后,甲、乙中B的体积分数均增大 |
W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素;W、X各自的最高价氧化物对应的水化物可以反应生成盐和水。
回答下列问题:
(1)W与Y可形成化合物W2Y,该化合物的电子式为:__________________。
(2)比较Y、Z气态氢化物的稳定性:________>________(用分子式表示)。]
(3)W、X、Y、Z四种元素形成的简单离子的离子半径由大到小的顺序是:
________>________>________>________(用离子符号表示)。
(4)下图是WZ晶体的一个“晶胞结构”示意图。
下列说法正确的是________。
| A.与W+ 距离相等且最近的Z— 共有8个 |
| B.与W+ 距离相等且最近的Z— 构成的多面体是八面体 |
| C.与W+ 距离相等且最近的W+ 有8个 |
| D.一个WZ晶胞中含有4个W+ 和4个Z— |
(5)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一 种稀酸溶液,并放出a KJ的热量。写出该反应的热化学方程式__________________________________。
种稀酸溶液,并放出a KJ的热量。写出该反应的热化学方程式__________________________________。
黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀至 2.12 L时测得其pH=0;将稀释后的溶液分为两等份,向其中一份溶液中滴加浓度为6. 05 mol/L的NaOH溶液,向另一份溶液中滴加0.600 mol/LBa(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶
05 mol/L的NaOH溶液,向另一份溶液中滴加0.600 mol/LBa(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶 液的体积变化如下图所示:
液的体积变化如下图所示: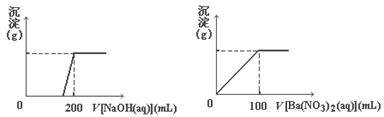
(1)请通过计算确定:m=________。
(2)X的摩尔质量为368 g/mol,则X的化学式为________________。
(3)将一定质量的Fe、Cu的混合物平均分成四等份,每份13.2 g,分别加入同浓度的稀硝酸 ,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO):
,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO):
| 实验编号 |
① |
② |
③ |
④ |
| 稀硝酸体积/mL |
100 |
200 |
300 |
400 |
| 剩余金属质量/g |
9.0 |
4.8 |
0 |
0 |
| NO体积/L |
1.12 |
2.24 |
3.36 |
V |
回答下列问题:
①写出实验①中发生反应的离子方程式___________________________________。
②实验④中V=________。
铁及其化合物之间的相互转化可用下式表示: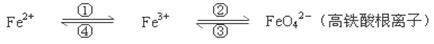
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净,可选用的试剂是________(选填序号)。
a.Cl2 b.Fe c.HNO3  d.H2O2
d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应CuFeS2+4Fe3+=Cu2++5 Fe2++2S(CuFeS2中S为—2价),下列说法正确的是________(选填序号)。
Fe2++2S(CuFeS2中S为—2价),下列说法正确的是________(选填序号)。
a.从物质分类的角度看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1 mol电子时,46 g CuFeS2参加反应
(3)下述反应中,若FeSO4和O2的系数比为2︰1,试配平下列方程式:
FeSO4 + K2O2→ K2FeO4 + K2O + K2SO4 + O2↑
实验室需要0.80 mol/L NaOH溶液475 mL和0.40 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是___________(填序号),配制上述溶液还需用到的玻璃仪器是________________________(填仪器名称)。
(2)根据计算用托盘天平称取NaOH的质量为_______g;根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为______mL。
(3)下图是某同学转移溶液的示意图,图中的存在的错误是_______________________。
(4)在实验中其他 操作均正确,若定容时俯视视刻度线,则所得溶液浓度_____0.8 mol/L(填“>、<或=”,下同)。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度_____0.8 mol/L。
操作均正确,若定容时俯视视刻度线,则所得溶液浓度_____0.8 mol/L(填“>、<或=”,下同)。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度_____0.8 mol/L。
如图的甲、乙两容器,甲体积可变压强不变,乙保持体积不变。向两容器中分别充入1 mol A、3 mol B,此时两容器体积均为500 mL,温度为T℃。保持温度不变,发生反应A(g)+3B(g) 2C(g)+D(s);△H<0。
2C(g)+D(s);△H<0。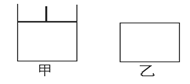
 (1)下列选项中,能表明甲和乙容器中反应一定达到平衡状态的是________。
(1)下列选项中,能表明甲和乙容器中反应一定达到平衡状态的是________。
A.混合气体的总质量不随时间改变 B.2 v正(C)=3 v逆(B)
C.A、B转化率相等 D. 物质D的质量不随时间改变
(2)2 min后甲容器中的化学反应达到平衡, 测得C
测得C 的浓度为2 mol/L,此时容器的体积为________mL,B的转化率α甲(B)为________。
的浓度为2 mol/L,此时容器的体积为________mL,B的转化率α甲(B)为________。
(3)乙容器中反应 达到平衡所需要的时间______2 min(填“>、<或=”),B的转化率α
达到平衡所需要的时间______2 min(填“>、<或=”),B的转化率α 乙(B) ______α甲(B) (填“>、<或=”)。
乙(B) ______α甲(B) (填“>、<或=”)。
(4)若其它条件不变,甲中如果从逆反应方向开始反应建立平衡,要求平衡时C的物质的量与(2)中平衡时C的物质的量相等,则需要加入C的物质的量n(C)=________mol,加入D的物质的量n (D)应该满足的条件为________________________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号