[湖北]2012届武汉市部分学校高三新起点调研测试化学试卷
下列化学用语正确的是( )
A.Na2S 的电子式: |
B.Clˉ的结构示意图: |
| C.I—131 : 78 53I | D.乙烯的结构式:CH2=CH2 |
用 NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A.在 lmol/ L 的 AlCl3溶液中,A13+的个数小于 NA |
| B.1 mol 碳烯(:CH2)中含有电子数为8NA |
C.标准状况下, lL 己烷的分子数为 |
| D.1 mol C4Hl0分子中含有的共价键数无法确定 |
下列关系不正确的是( )
| A.离子半径:Clˉ> F ˉ> Na+ > Al3+ |
| B.熔点:石英>食盐>冰>干冰 |
| C.结合氢离子的能力:SO42ˉ> SO32ˉ> CO32ˉ |
| D.热稳定性: HF > HCI > H2S > PH3 |
常温下,下列各组离子在指定溶液中可能大量共存的是 ( )
| A.滴人甲基橙显红色的溶液中: Na+、NO3ˉ、 Iˉ、SO32ˉ |
| B.水电离出的 c(H+)= 10ˉ12 mol/L 的溶液中:K+、 AlO2ˉ、 CH3COOˉ、SiO32ˉ |
C. =10ˉ12的溶液中: K+、ClOˉ、S2ˉ、 Clˉ =10ˉ12的溶液中: K+、ClOˉ、S2ˉ、 Clˉ |
| D.c(Fe 3+) = 0.1 mol/L 的溶液中: K+、ClOˉ 、SO42ˉ、 SCNˉ |
能区别 NaCl 、 AgCl 、CuSO4、 MgCl2四种固体的试剂是( )
| A.蒸馏水 | B.蒸馏水、硝酸 |
| C.蒸馏水、氨水 | D.蒸馏水、 BaC12溶液 |
关于甲醛(CH2O)分子,下列说法不正确的是 ( )
①分子中碳原子采用。 SP2杂化;②分子中所有原子处于同一平面上;
③分子中每个原子都达到 8 电子稳定结构;④分子的立体构型为四面体
| A.①② | B.②③ | C.③④ | D.①④ |
下列解释原理的表达式中,不正确的是 ( )
A.镁的冶炼: |
B.用热的纯碱溶液清洗油污: |
C.用Na2CO3溶液处理水垢中的CaCO4: |
| D.用氢氟酸刻蚀玻璃:4HF+SiO2=SiF4↑+2H2O |
在常温下,将一定体积的某 NaOH 溶液分成两等分,与pH 均为2的一元酸 HA、HB恰好中和,消耗两种酸溶液的体积分别为V1、V2(V1≠V2)。则下列叙述中正确的是( )
A.若 Vl>V2,则说明 HA 的酸性比 HB的酸性强
B.中和后得到的两种溶液的 pH 均为 7
C.分别将两种酸溶液稀释10 倍后溶液的 pH 均为3
D.分别往等体积的两种酸溶液中加人足量锌粉,充分反应后产生的 H2的体积相等
用下列实验装置完成对应的实验(部分仪器略去),能达到实验目的的是( )
| A |
B |
C |
D |
 |
 |
 |
 |
| 制取乙酸乙酯 |
检查装置的气密性 |
定量测定 H2O2的分解速率 |
证明 CH3CH2OH 发生消去反应生成了乙烯 |
Al、Fe、Cu 都是重要的金属元素。下列说法正确的是 ( )
| A.三种金属单质在常温下均可溶于浓硫酸 |
| B.三种金属单质放置在空气中均只能生成氧化物 |
| C.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al. |
| D.制备AlCl3、FeCl3、CuCl2三种固体物质,均不能采用将溶液直接蒸干的方法 |
右图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,
下列叙述正确的是( )
A.盐酸的物质的量浓度为 1 mol/L |
B.P 点时反应恰好完全中和,溶液呈中性 |
| C.曲线 a 是盐酸滴定氢氧化钠的滴定曲线 | |
| D.酚酞不能用做本实验的指示剂 |
铁氧磁体法处理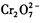 的废水的原理可概述为:向
的废水的原理可概述为:向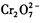 的酸性废水中加人FeSO4·7H2O ,将
的酸性废水中加人FeSO4·7H2O ,将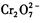 还原为Cr3+,调节溶液的 pH,使溶液中的铁、铬元素转化为组成相当于FeⅡ[FeⅢ XCrⅢ 2-X]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀。处理含 1 mol
还原为Cr3+,调节溶液的 pH,使溶液中的铁、铬元素转化为组成相当于FeⅡ[FeⅢ XCrⅢ 2-X]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀。处理含 1 mol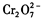 的废水至少需要加人amol FeSO4·7H2O 。下列结论正确的是( )
的废水至少需要加人amol FeSO4·7H2O 。下列结论正确的是( )
| A.x= 0.5 , a= 8 | B.x = 0.5 , a=10 | C.x = 1.5 , a= 8 | D.x = 1.5 , a= 10 |
(12 分)能源问题是人类社会面临的重大课题。甲醇是未来重要的绿色能源之一。
(l)已知:在 25 ℃、101 kPa 下,1g 甲醇燃烧生成 CO2和液态水时放热 22.70kJ 。请写出甲醇燃烧的热化学方程式 。
(2)由CO2和H2合成甲醇的化学方程式为:CO2(g)+ 3H2 (g) CH3OH(g)+H2O (g ).在其它
CH3OH(g)+H2O (g ).在其它 条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大于300 ℃)
条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大于300 ℃)
①合成甲醇反应的△H 0。(填“>”、“<”或“=”)。
②平衡常数的表达式为: .温度为T2时的平衡常数 温度为T1时的平衡常数(填“>”、“<”或“=”)
③在T1温度下,将1mol CO2和 1 molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为α,则容器内的压强与起始压强的比值为 。
(3)利用甲醇燃料电池设计如下图所示的装置。
该装置中 Pt 极为 极;写出 b极的电极反应式 .
短周期元素 X、Y、Z 可组成化学式均为 XYZ3的四种化合物甲、乙、丙、丁。
(l)若甲中 X 的原子只有一个质子,Y 、Z均是第二周期元素,则 Y 元素原子的电子排布式为 ; X、Y 原子间可形成与烷烃结构类似的化合物,则该系列化合物的通式为 。
(2)若乙是一种微溶于水的物质,其 Ksp 约为 6.8×10ˉ6,且 X、Y、Z 三种元素的原子序数之和为 26 , Y、Z 同周期,则乙的溶解平衡可表示为 ,其饱和溶液中X的离子的物质的量浓度约为 mol/ L.
(3)若丙中X元素的焰色反应为黄色,Y与X同周期,Y 是同周期中原子半径最小的元素,丙与浓盐酸反应生成 Y 单质的化学方程式为 .
(4)若丁中 X、Y、Z 处于不同周期,且 X 原子最外层电子数为其次外层电子数的二倍,Z原子最外层电子数是其电子层数的二倍多1,则丁的结构式为 。
某研究性学习小组利用如图所示装置完成有关实验。
【实验一】快速制氨气
(1)用装置I快速制氨气,则装置I的a仪器中可加入浓氨水,b仪器中加入 。装置Ⅱ从 管口进气可作为氨气的收集装置。
【实验二】收集NO
(2)利用装置Ⅱ可收集NO,试简述操作方法: 。
【实验三】比较硫、碳、硅三种元素的非金属性强弱
(3)设计实验,完成下列表格(可以不填满,也可以再加行)
| 装置序号 |
仪器中所加物质名称 |
现象 |
| |
|
|
| |
|
|
| |
|
|
乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去)。
请回答下列问题:
(1) A 的化学名称是 ;
(2) B 和 A 反应生成 C 的化学方程式为 ,该反应的类型为 ;
(3) D 是环状化合物,它的结构简式为 ;
(4) F 的结构简式为 。
水是生命之源,它 与我们的生活密切相关。在化学实验中,水也是一种常用的试剂。
与我们的生活密切相关。在化学实验中,水也是一种常用的试剂。
(1)水分子与H+形成水合氢离子( H3O +)的立体构型为 。
(2)冰是立方面心结构。下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞示意图(未按顺序排序)。上述五种晶体中与冰的晶体类型相同的是 ;(填写编号)。
(3)在冰的晶体中,每个水分子与相邻的 4 个水分子形成氢键(如图所示),
已知冰的升华热(即 1 mol 水由冰转化为水蒸汽所需能量)是51KJ/mol,除氢键外,水分子间还存在范德华力(11 kJ / mol ) , 则冰晶体中氢键的“键能”(破坏 lmd 氢键所需的能量即为氢键的“键能”)是 KJ kJ / mol 。
钛是一种重要的金属,工业上用钛铁矿(主要成分为FeTiO3,含FeO、Al2O3、SiO2等杂质)为原料制钛白粉(TIO2 ) , TiO2常通过两种方法可制得 Ti。
其中, 2H2SO4+ FeTiO3 = TiOSO4+ FeSO4+ 2H2O 。回答下列问题。
(l)净化钛矿石时,需用浓氢氧化钠溶液来处理,该过程中发生反应的化学方程式有:
SiO2+2NaOH =Na2SiO3 + H2O 和
(2)滤液①中的溶质主要是 FeSO4,检验其中Fe2+的方法是: .
(3)从 TiOSO4→H2TiO3需要加热,则加热的目的是: 。
(4)电解 TiO2来获得 Ti 是以 TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池。其阴极反应的电极反应式为: .
(5)从化学平衡的角度解释:往TiO2和Cl2反应体系中加人焦炭后,能使反应 TIO2(s) + 2C12(g) TICl4(l) +O2(g)顺利进行的原因是:
TICl4(l) +O2(g)顺利进行的原因是:


 粤公网安备 44130202000953号
粤公网安备 44130202000953号