实验室也可用反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O来快速制取氯气。
(1)请标出电子的转移方向和数目
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)若产生标准状况下Cl2 11.2L,则反应过程中转移的电子数为________ ,被氧化的还原剂
的物质的量为___________。
(3)需消耗36.5%的浓盐酸多少质量?
Fe、Ca是重要的金属元素。运用所学知识,回答下列问题。
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式: ;
(2)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,该现象说明该溶液中含有的离子是 ;
②验证该溶液中含有Fe2+,正确的实验方法是 ;
A.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
B.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
C.观察溶液是否呈浅绿色
(3)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。正常人体血液含Ca2+为2.2×10-3~2.7×10-3mol·L-1。现抽取某人血样10ml。稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙CaC2O4沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0ml 5.0×10-3 mol·L-1KMnO4溶液与溶解得到的草酸恰好完全反应。据此可求此人血液中的Ca2+的浓度,并判断其血液含钙量是否正常。
(提示2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O)
①配制5.0×10-3 mol·L-1KMnO4 200mL溶液,需要称取KMnO4固体的质量是 g;
②每消耗草酸0.5mol,转移电子的物质的量为 mol;
③此人血液中的Ca2+的浓度为 mol·L-1。
CuSO4溶液与K2C2O4溶液混合生成一种蓝色钾盐水合物KaCub(C2O4)c·nH2O。通过下述实验确定该晶体的组成。
步骤a:称取0.6720 g样品,放入锥形瓶,加入适量2mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.2000mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL KMnO4溶液。有关反应:2MnO4-+5C2O42-+16H+=2Mn2++8H2O+10CO2↑
步骤b:接着将溶液充分加热。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.2500mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL Na2S2O3溶液。滴定时反应为:I2+2S2O32-=2I-+S4O62-
(1)步骤b中生成白色沉淀的离子方程式: 。
(2)步骤b中“将溶液充分加热”的目的是 。
(3)请完成下列确定样品组成的计算过程。
①计算样品中n (C2O42-)(写出计算过程)
②计算样品中n (Cu2+) (写出计算过程)
③根据 原理可求出n (K+),再依据 原理求得n (H2O)
④该样品晶体的化学式为
(1)向NaHSO4溶液中逐滴加入Ba(OH) 2溶液使SO42-恰好沉淀完全,请写出发生反应的离子方程式:______ 。
(2)在一定条件下,RO4n--和I-发生反应的离子方程式如下:RO4n- +8I- +8H+= R- +4I2 +4H2O中R元素的化合价为 .
(3)常温常压下,将CO与CH4的混合气体10L与25L氧气混合,点燃后充分反应,则剩余气体为24L(恢复为常温常压),则原来混合气体中CO与CH4的体积比为 。
(4)以物质的量之比为1:2相混合的Na2SO3和K2SO3的混合物共a g,与足量盐酸反应生成的SO2物质的量n(SO2)= mol(用含a的代数式表示)。
储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化汽化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3、H2O七种物质。
(1)请用上述物质填空,并配平化学方程式:
(2)上述反应中氧化剂是(填化学式)_______________,被氧化的元素是(填元素符号)_____________。
(3)H2SO4在上述反应中表现出来的性质是(填选项编号)____________________。
A.氧化性 B.酸性 C.氧化性和酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为________升。
草酸晶体的化学式可表示为H2C2O4·xH2O,为测定x值进行下列实验:
(1)称取wg草酸晶体,配成100.00 mL溶液。
(2)取25.00mL所配溶液置于锥形瓶中,加入适量稀硫酸后,用浓度为a mol/LKMnO4溶液滴定。KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O(未配平)
回答下列问题:
①滴定时,KMnO4溶液应盛在__________(填酸式或碱式)滴定管中;
②若滴定用的KMnO4溶液因放置而变质,浓度偏低,则根据实验求出的x值______(填偏高、偏低或无影响);
③滴定终点时,锥形瓶内溶液颜色变化是_____________________;
④若滴定终点时,共用去KMnO4溶液V mL,求x的值为________________。
硝酸盐受热分解的产物与硝酸盐的组成以及受热的温度等因素有关。
Ⅰ.一定条件下硝酸铵受热分解的化学反应方程式为:NH4NO3→HNO3+N2 +H2O(未配平)
(1)该反应中发生还原反应的过程是_______→________。
(2)反应中被氧化与被还原的氮原子数之比为__________;现有1mol NH4NO3分解,生成的氧化产物的物质的量是 mol。
Ⅱ.硝酸铵受撞击或高温发生爆炸的化学反应方程式为:m NH4NO3→n O2+p N2+q H2O
(3)下列关于该方程式中化学计量数的说法正确的是_________(选填字母编号)。
a.m=1 b.n=2 c.p=3 d.q=4
(4)若反应过程中共转移3.01×1023个电子,则反应可产生气体的体积为_____(标准状况)。

如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
① 反应C+G B+H能放出大量的热,G是红综色固体粉末;
B+H能放出大量的热,G是红综色固体粉末;
②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
(1)①中反应的化学方程式为____________________________________
(2) 1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,至少需要铜粉_______克
(3) C与过量NaOH溶液反应的离子方程式为________________________,反应后的溶液与过量的化合物I反应的离子方程式为________________________________
(4) E与I反应的化学方程式为__________________________________
(5) 写出H物质在工业上的一种用途_____________。
(6)将一定量的B完全溶于过量盐酸中,然后通入0.005mol Cl2,再加入0.01mol重铬酸钾晶体(K2Cr2O7),恰好使溶液中B2+全部转化为B3+,铬元素本身被还原为+3价铬离子。通过计算确定原B的物质的量为( )
A.0.01mol B.0.03mol C.0.04mol D.0.07mol
磁性氧化铁(Fe3O4)可用于制造录音磁带和电讯器材,其溶于稀硝酸的化学方程式为:
3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O。
(1)Fe3O4晶体的颜色为______________。
(2)Fe(NO3)2在水溶液中的电离方程式为________________________。
(3)上述反应中,氧化剂是_____________(填化学式),被还原的氮元素与未被还原的氮元素的物质的量之比为_________,每生成2.24L(标准状况下)NO时,转移电子的物质的量为____________mol。
化合物KaFeb(C2O4)c·dH2O(其中铁为正三价)是重要的光化学试剂。通过下述实验确定该晶体的组成。
步骤a:称取该样品4.91g溶于水中配成250mL溶液,取出25mL溶液,向其中加入过量的NaOH溶液,将沉淀过滤,洗涤,高温灼烧至质量不再改变,称量其固体的质量为0.08g。
步骤b:另取出25mL溶液,加入适量稀H2SO4溶液,用0.050 mol·L-1KMnO4溶液滴定,到达滴定终点时,消耗KMnO4溶液24.00mL。
已知: KMnO4+ H2C2O4+ H2SO4= MnSO4+ K2SO4+ CO2+ H2O
(1) 配平上述反应方程式
(2) 草酸为二元弱酸,其一级电离的方程式为 。
(3)滴定终点观察到的现象为 。
(4)通过计算确定样品的组成(写出计算过程)。
Cl2、Br2、I2都具有氧化性,其氧化性Cl2>Br2>I2,Cl2能把溴从溴化物中置换出来,其余类推。
(1)实验室用MnO2制备Cl2的反应中氧化剂是 ,氧化产物是 。将17.4g MnO2与足量的浓盐酸反应,则被氧化的HCl的物质的量为 。
(2)将溴水滴入KI溶液中的化学方程式为 。
Ⅰ、现有A g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子的个数为________________个。
(2)该气体在标准状况下的密度为_______________ g/L。
(3)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为________________mol/L。
Ⅱ、已知食盐常加人KIO3来补充碘元素,检验食盐中是否加碘,可利用如下反应:KIO3+5KI+3H2SO4 3K2SO4+3I2+3H2O
3K2SO4+3I2+3H2O
(1)如果反应中转移0.2mol电子,则生成I2的物质的量为 mol。
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气)
若反应中消耗Cl2 1.5 mol,则被氧化的NH3在标准状况下的体积为______ L。
氧化还原反应在生产、生活中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂.用所学知识回答问题:
(1)3H2SO4+2 KMnO4+5H2O2=K2SO4+2MnSO4+5 O2↑+8 H2O,当有6 mol H2SO4参加反应的过程中,有 mol还原剂被氧化。
(2)在稀硫酸中,KMnO4与H2C2O4反应的离子方程式为
(3)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol。
(4)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶 液先变为浅绿色的离子方程式是 ,又变为棕黄色的原因是
某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀CuI。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
已知:I2+2S2O32-=S4O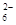 +2I-
+2I-
①可选用_____作滴定指示剂,滴定终点的现象是_______________________________ 。
②CuCl2溶液与KI反应的离子方程式为_______________________________________。
③该试样中CuCl2·2H2O的质量百分数为________。