下列溶液中有关物质的量浓度关系正确的是( )
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+)=c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-) +2c(OH-)=2c(H+) + c(CH3COOH)
D.0.1mol・L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
下列各溶液中,有关成分的物质的量浓度关系正确的是 ( )
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:c(Cl-)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
D.pH相等的(NH4)2SO4、 (NH4)2Fe (SO4)2、NH4Cl溶液:c(NH4Cl)<c[(NH4)2Fe (SO4)2]<c[(NH4)2SO4]
常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通入少量CO2气体生成HX和NaHCO3;往NaY溶液中通入少量CO2生成HY和Na2CO3。下列有关叙述正确的是 ( )
| A.酸性由强至弱:HX>HY>H2CO3 |
| B.结合H+的能力:Y->CO32->X->HCO3- |
| C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3 |
| D.NaX溶液中通入足量CO2后的离子浓度: c(Na+)>c(HCO3-)>c(X-)>c(OH-)>c(H+) |
下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.NaHRO3溶液中(R表示S或C):c(Na+) >c(HRO3-)>c(OH-)>c(H+)>c(RO32-)
B.常温下将醋酸钠、盐酸两溶液混合后呈中性,则混合溶液中:c(Na+)>c(Cl-)>c(CH3COOH)
C.常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<②
D.等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数:N前﹥N后
25℃时,有下列四种溶液,下列说法正确的是
| ① |
② |
③ |
④ |
| 0.1mol/L的氨水 |
pH=11的氨水 |
0.1mol/L的盐酸 |
pH=3的盐酸 |
A.①稀释到原来的100倍后,pH与②相同
B.等体积①③混合、等体积②④混合所得的溶液都成酸性
C.①②中分别加入少量CH3COONa固体, 的值变小
的值变小
D.将20mL的①溶液与10mL的③溶液混合后,若溶液呈碱性,则c(NH4+)>c(Cl-)> c(NH3∙H2O)> c(OH-)>c(H+)
(2012年高考安徽卷)氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时:
①HF(aq)+OH-(aq)===F-(aq)+H2O(l) ΔH=-67.7 kJ·mol-1
②H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
在20 mL 0.1 mol·L-1氢氟酸中加入V mL 0.1 mol·L-1NaOH溶液。下列有关说法正确的是( )
| A.氢氟酸的电离方程式及热效应可表示为:HF(aq) F-(aq)+H+(aq) ΔH=+10.4 kJ·mol-1 |
| B.当V=20时,溶液中:c(OH-)=c(HF)+c(H+) |
| C.当V=20时,溶液中:c(F-)<c(Na+)=0.1 mol·L-1 |
| D.当V>0时,溶液中一定存在:c(Na+)>c(F-)>c(OH-)>c(H+) |
下列溶液中微粒浓度关系一定正确的是( )
A.氨水与氯化铵的pH=7的混合溶液中: (Cl-) (Cl-) |
B.新制氯水中: (Cl-) (Cl-) (ClO-) (ClO-) |
C.室温下,向0.01mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性: |
D.pH=2的一元酸和pH=12的一元强碱等体积混合: |
常温下,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是
| A.在0.1 mol·L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| B.当溶液的pH为7时,溶液的总体积为20 mL |
| C.在B点所示的溶液中,浓度最大的离子是Na+ |
| D.在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-) |
在常温下,0.1000mol·L-1Na2CO3溶液25mL 用0.1000mol·L-1盐酸滴定,其滴定曲线如下图。对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )

| A.a点:c(CO2-3)=c(HCO-3)>c(OH-) |
| B.b点:5c(Cl-)>4c(HCO-3)+4c(CO2-3) |
| C.c点:c(OH-)=c(H+)+c(HCO-3)+2c(H2CO3) |
| D.d点:c(H+)=c(CO2-3)+c(HCO-3)+c(OH-) |
在化学学习中,利用类比推理是一种学习的好方法。以下类比推理正确的是
| A.ⅣA族元素的简单氢化物CH4、SiH4、GeH4、SnH4的沸点随相对分子质量增大而升高,可推知VA族元素氢化物的沸点也具有完全同样的变化规律 |
| B.加热Ca(HCO3)2水溶液,低温蒸发至干,最终产物为CaCO3,从而有Mg(HCO3)2水溶液加热蒸发结晶后的最终产物为MgCO3 |
| C.CO2通入CaCl2溶液中无沉淀生成,因此SO2通入BaCl2溶液中也没有沉淀生成 |
| D.AlCl3溶液中加入Na2S的离子方程式为:2Al3++3S2—+6H2O==2Al(OH)3↓+3H2S↑可知FeCl3溶液中加入Na2S的离子方程式为:2Fe3++3S2—+6H2O==2Fe(OH)3↓+3H2S↑ |
根据右表提供的数据,下列判断正确的是
A.同温同浓度下,溶液的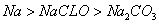 |
B.结合 H+的能力: H+的能力: |
C.碳酸钠溶液中加入少量氢氟酸的离子方程式: |
| D.次氯酸钠溶液中通少量二氧化碳的离子方程式: |
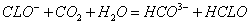
有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成:①CH3COONa与HCl;②CH3COONa与NaOH③CH3COONa与NaCl④CH3COONa与NaHCO3
下列各项排序正确的是
| A.pH:②>③>④>① | B.c(CH3COO-):②>④>③>① |
| C.溶液中c(H+):①>③>②>④ | D.c(CH3COOH):①>④>③>② |
下列各溶液中,微粒的物质的量浓度关系正确的是
| A.0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| B.0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-) |
已知常温下:PH(NaHCO3)>7>PH(NaHSO3)。则在NaHCO3或NaHSO3溶液中,有关微粒的物质的量浓度表示式一定正确的是(X表示S或C)( )
A.C(Na+)>C(HXO3-)>C(OH-)>C(H2XO3)>C(XO32-)
B.C(Na+)+C(H+)=C(OH-)+C(XO32-)+C(HXO3-)
C.C(H2XO3)+C(HXO3-)+C(XO32-)=C(Na+)
D.C(OH-)=C(H+)+C(HXO3-)+C(H2XO3)