在常温下,0.1000mol·L-1Na2CO3溶液25mL 用0.1000mol·L-1盐酸滴定,其滴定曲线如下图。对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
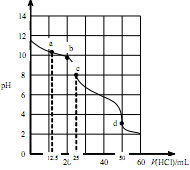
| A.a点:c(CO2-3)=c(HCO-3)>c(OH-) |
| B.b点:5c(Cl-)>4c(HCO-3)+4c(CO2-3) |
| C.c点:c(OH-)=c(H+)+c(HCO-3)+2c(H2CO3) |
| D.d点:c(H+)=c(CO2-3)+c(HCO-3)+c(OH-) |
在常温下,0.1000mol·L-1Na2CO3溶液25mL 用0.1000mol·L-1盐酸滴定,其滴定曲线如下图。对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )

| A.a点:c(CO2-3)=c(HCO-3)>c(OH-) |
| B.b点:5c(Cl-)>4c(HCO-3)+4c(CO2-3) |
| C.c点:c(OH-)=c(H+)+c(HCO-3)+2c(H2CO3) |
| D.d点:c(H+)=c(CO2-3)+c(HCO-3)+c(OH-) |