(6分)按要求回答下列问题
(1)已知反应:mA(g) + nB(g) pC(g) + qD(g),v(A):v(B)= _________________;
pC(g) + qD(g),v(A):v(B)= _________________;
(2)任何情况下判断水溶液呈中性的依据是:_______________;
(3)NH4Cl溶液中离子浓度由大到小的顺序是:_________________。
在温度T ℃下,某Ba(OH)2稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入NaHSO4溶液,测得混合溶液的部分pH如下表所示:
| 序号 |
氢氧化钡的体积/mL |
硫酸氢钠的体积/mL |
溶液的PH |
| ① |
33.00 |
0.00 |
8 |
| ② |
33.00 |
X |
7 |
| ③ |
33.00 |
33.00 |
6 |
(1)依据题意判断,T ℃________25 ℃(填“大于”、“小于”或“等于”);
(2)b= ,X= ;
(3)反应③的离子方程式为: ;
(4)将此温度下的Ba(OH)2溶液取出1 mL,加水稀释至1L,则稀释后溶液中c(Ba2+):c(OH-) 。
pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加_________mL;
(2)如果加入pH=10的NaOH溶液,应加_________mL;
某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)________。
(2)判断滴定终点的现象是:锥形瓶中溶液从________色变为________色,且半分钟内不变色。
(3)如图是某次滴定时的滴定管中的液面,其读数为________mL。
(4)根据下列数据:请计算待测盐酸溶液的浓度为________mol/L。
| 滴定次数 |
待测液体积(mL) |
标准NaOH溶液读数记录(mL) |
|
| 滴定前读数 |
滴定后读数 |
||
| 第一次 |
20.00 |
0.40 |
20.40 |
| 第二次 |
20.00 |
4.00 |
24.00 |
| 第三次 |
20.00 |
2.00 |
24.10 |
(共4分)
(1)25℃时,水的离子积常数KW为1.0×10—14;在pH=2的稀硫酸中,c(OH—) = ;若升高温度,会使KW 数值 (填“增大”、“减小”或“不变”)。
(2)在醋酸水溶液中存在平衡CH3COOH CH3COO—+H+。若分别改变下列条件:①加水稀释 ②加热 ③加少量固体醋酸钠,其中能使醋酸电离程度增大的是 ,能使溶液pH增大的是 (填序号)。
CH3COO—+H+。若分别改变下列条件:①加水稀释 ②加热 ③加少量固体醋酸钠,其中能使醋酸电离程度增大的是 ,能使溶液pH增大的是 (填序号)。
在t℃时,某NaOH稀溶液中,c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=13,则:
(1)该温度下,水的离子积常数Kw= 。
(2)该温度下,100mL 0.1mol/L的稀硫酸溶液中由水电离的c(OH-)= mol/L。
(3)该温度下,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前该强酸的pH1与强碱的pH2应满足的关系是 。(用含有a和b的式子表示)
(4)该温度下,pH=3的硫酸溶液和pH=8的NaOH溶液等体积混合后,混合溶液的pH (填>7、=7、<7);pH=5的硫酸溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH (填>7、=7、<7)。
根据所学知识填空。
(1)写出此分子 含有的官能团名称 。
含有的官能团名称 。
(2)写出铝热反应的化学方程式 。
(3)用离子方程式表示泡沫灭火器的灭火原理 。
(4)根据沉淀溶解平衡原理,用离子方程式解释碳酸钙溶于盐酸的过程 。
(5)写出有机物名称为 2,5 -二甲基-4-乙基庚烷的结构简式 。
(6)常温下,将pH=5的盐酸和pH=9的NaOH溶液以一定的体积比混合后,所得溶液的pH=6,则盐酸和氢氧化钠溶液的体积比是 。
(7)下列8组物质,互为同分异构体的是 组。
①甲烷和十七烷 ②金刚石和石墨 ③O2和O3 ④甲苯和苯乙烯
⑤邻二甲苯和间二甲苯 ⑥12C 和14C ⑦ 和
和 ⑧2-丁炔和1,3-丁二烯
⑧2-丁炔和1,3-丁二烯
钾水玻璃以其优异的性能广泛用于防腐、铸造、油田、钻井或各种高档涂料中。钾水玻璃中硅含量的测定可以采用氟硅酸钾容量法,其步骤为:
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液。
(1)上述步骤②中的水解反应方程式为 ;步骤③中反应的离子方程式为: 。
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将 (填“偏高”、或“偏低”或“不变”)。
(3)在步骤③中,需要 1.00 mol·L-1氢氧化钠标准溶液450mL,配制该溶液需用托盘天平称取___gNaOH固体。
现有浓度均为0.1 mol·L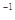 的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H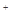 浓度由大到小的顺序是_____(填序号)。
浓度由大到小的顺序是_____(填序号)。
(2)④、⑤、⑥、⑦四种溶液中NH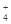 浓度由大到小的顺序是_____(填序号)。
浓度由大到小的顺序是_____(填序号)。
(3)已知t℃时,K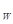 =1×10
=1×10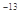 。现在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=_____ 。
。现在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=_____ 。
(1)将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1∶V2=____________.(溶液体积变化忽略不计)
(2)常温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,根据题意,回答下列问题:
①若由0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合而得,则溶液的pH________7(>、≥ 、=、<)。
②若溶液pH>7,则c(Na+)________c(A-),理由是________________________。
③若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是______(填选项代号)。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol/L |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
填空
(1)、甲溶液的pH是2,乙溶液的pH是4,求甲溶液和乙溶液的c(H+)之比为 。
(2)、电解饱和食盐水时,阴极析出气体是 (填化学式)。
(3)、现有学生做如下实验:将盛有滴加酚酞的0.1 mol/L NaHCO3溶液的试管微热时,观察到该溶液的浅红色加深;若冷却至室温时又变回原来的浅红色,发生该现象的主要原因是 。(结合离子反应方程式说明)
(4)、已知25℃时,醋酸和亚硫酸的电离平衡常数:醋酸K=1.75×10-5 ,亚硫酸K1=1.54×10-2、
K2=1.02×10-7。则25℃时,相同浓度醋酸和亚硫酸溶液的酸性强弱:CH3COOH H2SO3(填>、<或=)。
(5)、向明矾溶液中逐滴加入Ba(OH)2溶液,若加至铝离子刚好完全沉淀,请写出反应的离子反应方程式: 。
(6)、炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请写出铁锅腐蚀正极的电极反应式: 。
已知:25℃时,H2SO3 Ka1=1.5×10﹣2 Ka2=1.0×10﹣7
H2CO3 Ka1=4.4×10﹣7 Ka2=4.7×10﹣11
HNO2 Ka=5.1×10﹣4 HClO Ka=3.0×10﹣8
饱和NaClO溶液的浓度约为3mol/L.
(1)室温下,0.1mol/L NaClO溶液的pH 0.1mol/L Na2SO3溶液的pH(选填“大于”、“小于”或“等于”).浓度均为0.1mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32﹣、CO32﹣、HSO3﹣、HCO3﹣浓度从大到小的顺序为 。
(2)下列离子反应正确的有: .
A.2HCO3﹣+SO2═SO32﹣+2CO2+H2O B.ClO﹣+CO2+H2O═HClO+HCO3﹣
C.ClO﹣+SO2+H2O═HClO+HSO3﹣ D.2ClO﹣+SO2+H2O═2HClO+SO32﹣
(3)某消毒液的有效成分为NaClO,还含有一定量的NaOH等,下列用来解释事实的方程式中不合理的是: .
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O
B.室温下,该消毒液的pH约为12,主要是因为:ClO﹣+H2O HClO+OH﹣
HClO+OH﹣
C.该消毒液加白醋生成HClO,可增强漂白作用:H++ClO﹣═HClO
D.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++Cl﹣+ClO﹣═Cl2↑+H2O
(4)25℃时,0.1mol下列气体分别与1L0.l mol·L﹣1的NaOH溶液反应(已知2NO2+2NaOH═NaNO2+NaNO3+H2O),形成的溶液的pH由大到小的顺序为: (用A、B、C、D表示).
A.NO2 B.SO3 C.SO2 D.CO2.
(5)下列说法不正确的是( )
A.在相同温度下将pH相同的稀硫酸和醋酸溶液等体积混合,所得混合液的pH与原来相同。
B.含等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO﹣)=c(HCO3﹣)+c(H2CO3)+c(CO32﹣)
C.CH3COOH溶液加水稀释后,溶液中c(H+)/C(CH3COO-)的值减小
(6)已知某温度下,0.10mol/LNH4Cl溶液的PH=5,则该温度下NH3·H2O的电离常数约为 。
现有室温下浓度均为1×10-3 mol·L-1的几种溶液:①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH溶液。回答下列问题:
(1)上述6种溶液中,水电离出的c(H+)最大的是________,最小的是________。
(2)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③____________⑥(填“>”“<”或“=”),溶液中的离子浓度由大到小的顺序为______________。
(3)将等体积的①、⑤混合,则溶液的pH________7(填“>”“<”或“=”),用离子方程式说明其原因: _________________________________。
(4)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为________________,最终产生H2总量的关系为________。
(5)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH大小关系为①________③(填“>”“<”或“=”,下同)。
(6)若将等体积的⑤、⑥溶液加热至相同温度后,溶液的pH大小关系为⑤________⑥。
19.下表是不同温度下水的离子积数据:
| 温度 / ℃ |
25 |
t1 |
t2 |
| 水的离子积常数 |
1×10-14 |
α |
1×10-12 |
试回答下列问题:
(1)若25<t1<t2,则α________1×10-14(填“>”“<”或“=”),作出此判断的理由是____________。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c (Na+)∶c (OH-)=________
(3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=____________。此溶液中各种离子的浓度由大到小的排列顺序是____________________。