铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O |
【改编】LED系列产品是被看好的一类节能新产品, 下图是一种氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是
| A.a处通入氢气,发生了还原反应:H2-2e-+2OH-=2H2O |
| B.b处通入氧气,为电池的正极 |
| C.该装置中只涉及两种形式的能量转化,电池中的KOH溶液也可用稀硫酸溶液代替 |
| D.P-型半导体连接的是电池负极 |
某充电宝锂离子电池的总反应为: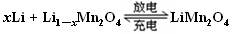 ,某手机镍氢电池总反应为:
,某手机镍氢电池总反应为: (M为储氢金属或合金),有关上述两种电池的说法不正确的是
(M为储氢金属或合金),有关上述两种电池的说法不正确的是
| A.锂离子电池放电时Li+向正极迁移 |
| B.镍氢电池放电时,正极的电极反应式:NiOOH+H2O+e-="=" Ni(OH)2+OH- |
| C.上图表示用锂离子电池给镍氢电池充电 |
| D.锂离子电池充电时,阴极的电极反应式:LiMn2O4—xe-="=" Li1-xMn2O4+ xLi+ |
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如下图装置①。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列有关叙述不正确的是
| A.该燃料电池负极发生的电极反应为:N2H4+4OH-−4e-==N2↑+4H2O |
| B.用该燃料电池作为装置②的直流电源,产生7.1g Cl2至少需加入0.5 mol N2H4 |
| C.该燃料电池中,电子从左侧电极经外电路流向右侧电极,溶液OH-迁移到左侧 |
| D.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
英国赫瑞瓦特大学陶善文博士研究出以尿素为动力的燃 料电池新技术。用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,关于该电池描述正确的是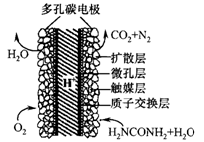
| A.电池工作时H+移向负极 |
| B.该装置还可以将电能转化成为化学能 |
| C.理论上电池工作时,每消耗67.2L O2时,可以净化2mol CO(NH2)2 |
| D.电池的负极反应式为:CO(NH2)2+H2O-6e-=CO2+N2+6H+ |
【改编】电化学方法是工业上常采用的一种污水处理方法。某含氮废水中含有NO3-,其降解的原理如图所示:


下列说法中不正确的是
| A.燃料电池的A极连接电解池的D级 |
| B.A电极的电极反应式为:CH4-8e-+2H2O = CO2+8H+ |
| C.燃料电池工作时H+移向左边 |
| D.每消耗标况下5.6 L甲烷,则电解池交换膜两侧电解液的质量变化差(Δm左—Δm右)为14.4g |
【原创】原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。另有元素R是用途最广泛的金属。
(1)W元素在周期表中的位置为 ;写出Y元素原子的价电子排布式: 。
(2)由X、Z两元素可以组成A、B两种化合物,A在一定条件下可以分解成B,A的电子式 。
(3)X、Y两元素按原子数目比3∶l和4∶2构成分子C和D,C的空间构型为 ,D—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,则D—空气燃料电池放电时,负极的电极反应式是: 。
(4)一定条件下,Y的单质气体与X的单质气体充分反应生成6.8g YX3气体,可放出18.44 kJ热量,则该反应的热化学方程式为 。
(5)科学家通过X射线探明,RO的晶体结构与NaCl的晶体结构相似,若在RO晶体中阴阳离子间最近距离为a cm,晶体密度为dg/cm3。则阿伏伽德罗常数NA表达式为 mol-1。
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法不正确的是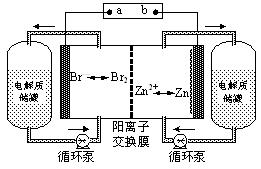
| A.充电时电极a连接电源的负极 |
| B.放电时负极的电极反应式为Zn—2e-=Zn2+ |
| C.放电时左侧电解质储罐中的离子总浓度增大 |
| D.阳离子交换膜可阻止Br2与Zn直接发生反应 |
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如下,有关说法正确的是
| A.电池总反应为:4NH3 + 3O2 = 2N2 + 6H2O |
| B.电池工作时,OH-向正极移动 |
| C.电极2发生的电极反应为:O2+4H+ + 4e-=2H2O |
| D.电流由电极1经外电路流向电极2 |
下图所示是一种新近开发的一种固态燃料电池。它以熔融的碳酸盐为电解质,以甲烷为燃料,a、b均为惰性电极。关于该电池的下列说法中正确的是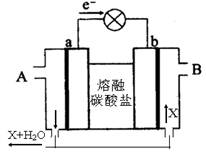
| A.A处通入空气,B处通入甲烷 |
| B.a极电极反应式:CH4+10OH--8e-=CO32-+7H2O |
| C.如用这种电池电镀铜,当镀件增重12.8g时,消耗标准状况下的空气2.24L |
| D.电池工作时电解质组成应保持稳定,因此必须有部分X物质参加循环,则X是二氧化碳 |
【改编】一种新型的乙醇电池,它用磺酸类质子溶剂。电池总反应为:C2H5OH +3O2→2CO2 +3H2O,电池示意如图,下列说法正确的是
| A.A处通氧气,B处通乙醇 |
| B.电池工作时电子由a极沿导线经灯泡再到b极 |
| C.电池正极的电极反应为:O2+2H2O+4e-=4OH— |
| D.若用这种电池作电源保护金属铁,则a电极连接石墨,b连接铁 |
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)写出CO燃烧的热化学方程式_____ ________;
(2)写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);

①温度升高该反应的平衡常数 (增大、减小、不变)
②B过程用H2表示该反应的化学反应速率是 mol·L-1·min-1
(4)在直接以甲醇为燃料的电池中,电解质溶液为碱性,总反应为:CH3OH+3/2O2+2OH-==CO32-+3H2O,负极的反应式为 。
【改编】下图是一种新型的质子交换膜二甲醚燃料电池(DDFC)。电池总反应为:CH3OCH3+3O2=2CO2+3H2O,下列说法正确的是
A.a极为电池的正极,失去电子
B.电池工作时电流由a极沿导线经灯泡再到b极
C.电池正极的电极反应为:12H++3O2+4e-=6H2O
D.电池工作时,1 mol二甲醚被氧化时就有12 mol电子转移
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:

(1)甲烷燃料电池负极反应式是 ;
(2)石墨(C)极的电极反应式为 ;
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成的气体体积为________L ,丙装置中阴极析出铜的质量为________g ;
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。

若用于制漂白液,a为电池的________极,电解质溶液最好用________;若用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用________作电极。
甲、乙、丙三种物质均由短周期元素组成,一定条件下,存在下列转化关系:
甲+乙→丙+H20
(1)若丙为Na2C03,反应的化学方程式为 (任写一个)。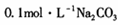 溶液中,所含的离子按物质的量浓度由大到小的顺序排列为 。
溶液中,所含的离子按物质的量浓度由大到小的顺序排列为 。
(2)若甲是石油裂解气的主要成分之一,乙为O2,且甲分子和乙分子具有相同的电子数。25℃、101 kPa时,1g甲完全燃烧生成CO2气体与液态水,放出50.5 kJ的热量,该反应的热化学方程式为 ;利用该反应设计的燃料电池中,通入甲的电极为电池的 (填“正极”或“负极”)。
(3)若甲、乙是同主族元素的化合物,丙为单质。
①丙所含元素在元素周期表中的位置为
②甲与水相比,热稳定性较强的是 (填化学式)。