某甲烷燃料电池构造示意图如下,关于该电池的说法不正确的是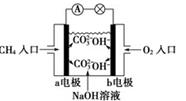
| A.a极是负极,发生氧化反应 |
| B.正极的电极反应是:O2+2H2O+4e-=4OH- |
| C.该甲烷燃料电池的总反应:CH4+2O2=CO2+2H2O |
| D.甲烷燃料电池是环保电池 |
I.已知0.3 mol的气态高能燃料乙硼烷(B2H6)在O2中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量,其热化学方程式为: 。
II.在某温度下,物质(t-BuNO)2在正庚烷或CCl4溶剂中均可以发生反应:
(t-BuNO)2 2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。
2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。
(1)向1L正庚烷中加入0.50mol(t-BuNO)2,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为60%(假设反应过程中溶液体积始终为1L)。反应在前10min内的平均速率为ν(t-BuNO)= 计算上述反应的平衡常数K = 。
(2)有关反应:(t-BuNO)2 2(t-BuNO) 的叙述正确的是( )
2(t-BuNO) 的叙述正确的是( )
A.压强越大,反应物的转化率越大
B.温度升高,该平衡一定向右移动
C.溶剂不同,平衡常数K值不同
III.甲醇燃料电池的电解质溶液是KOH溶液。则负极的电极反应式为 。
右图是一种正在投入生产的大型蓄电系统的原理图。电池的中间为只允许钠离子通过的离子选择性膜。电池充、放电的总反应方程式为:2Na2S2+NaBr3 Na2S4+3NaBr
Na2S4+3NaBr
下述关于此电池说法正确的是
| A.充电的过程中当O.1 mol Na+通过离子交换膜时,导线通过0.1 mol电子 |
| B.电池放电时,负极反应为:3NaBr一2e-=NaBr3+2Na |
| C.充电过程中,电极a与电源的正极相连 |
| D.放电过程中钠离子从右到左通过离子交换膜 |
(15分)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成CO,充分燃烧时生成CO2,反应放出的能量如图1所示
(1)在通常状况下, 更稳定(填“金刚石”或“石墨”),金刚石转化为石墨的热化学方程式为 。
(2)CO、O2和熔融Na2CO3可制作燃料电池,其原理见图2。石墨Ⅰ上电极反应式为 。
(3)用CO2生产甲醇燃料的方法为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol,将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图3所示(实线)。图中数据a(1,6)表示:在1min时H2的物质的量是6 mol。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图3所示(实线)。图中数据a(1,6)表示:在1min时H2的物质的量是6 mol。
①下列时间段平均反应速率最大的是 。
| A.0~1min | B.1~3min | C.3~8min | D.8~11min |
②仅改变某一个实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线Ⅰ对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 ,体积不变,再充入3molCO2和4molH2,H2O(g)的体积分数 (填“增大”“减小”或“不变”)。
PM2.5污染跟工业燃煤密切相关,燃煤还同时排放大量的SO2和NOX。
(1)在一定条件下,SO2气体可被氧气氧化,每生成8 g SO3气体,放出9.83 kJ的热量,写出该反应的热化学方程式 。若起始时向密闭容器内充入0.4molSO2和0.2mol O2,达平衡后放出的热量为Q,则Q 39.32kJ(填“>”、“<”或“=”).
(2)一定条件下,在恒容密闭的容器中,当上述反应达到平衡时,下列说法正确的是__________(填序号)
a.2v逆(SO2)=v正(O2)
b.ΔH保持不变
c.混合气体密度保持不变
d.混合气体的平均相对分子质量保持不变
(3)500℃时,在催化剂存在条件下,分别将2 mol SO2和1 mol O2置于恒压容器I和恒容容器II中(两容器起始容积相同,),充分反应均达到平衡后,两容器中SO2的转化率关系是I_________II(填“>”、“<”或“=”)。若测得容器II中的压强减小了30%,则该容器中SO3体积分数为 (结果保留3位有效数字)。
(4)将生成的SO3溶于水,再向溶液中通入NH3得到1L cmol/L(NH4)2SO4溶液的PH=5,计算该(NH4)2SO4溶液的水解平衡常数Kh= 。
(5)NO2、O2和熔融NaNO3可制作原电池,其装置见下图。该电池中Na+向 _____电极移动(填“Ⅰ”或“Ⅱ”),在电池使用过程中石墨I电极上生成氧化物Y,其电极反应为 。
设计出燃料电池使天然气CH4氧化直接产生电流是对世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入天然气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。回答如下问题:
(1)这个电池的正极发生的反应是: ;
(2)固体电解质里的O2-向 极(填“正”或“负”);
(3)天然气燃料电池最大的障碍是氧化反应不完全,产生 堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年时间,正是新一代化学家的历史使命。
(4)若将此甲烷燃料电池设计成在25%的KOH溶液中的电极反应,该电池的负极区域的碱性会_______(填“增强”、“减弱”或“不变”)。
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
关于该电池的说法正确的是
| A.放电时,Zn作负极,发生还原反应 |
| B.放电时,K2FeO4附近溶液pH减小 |
| C.充电时,锌极附近溶液pH减小 |
| D.充电时,阳极电极反应为:Fe(OH)3-3e-+5OH-===FeO42-+4H2O |
查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e-→X+2H+。下列说法中正确的是
| A.电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O |
| B.另一极的电极反应式为:O2 + 4e- + 2H2O = 4OH- |
| C.乙醇在正极发生反应,电子经过外电路流向负极 |
| D.电池内部H+由正极向负极移动 |
有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成燃料电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是
| A.每消耗1molCH4可以向外电路转移4mol电子 |
| B.负极上CH4失去电子,电极反应式为CH4+10OH—=CO32—+7H2O+8e— |
| C.负极上是O2获得电子,电极反应式为:O2+2H2O+4e—=4OH— |
| D.电池放电后,溶液pH不断升高 |
一种使用阴离子交换膜(只也许阴离子通过)的铜锌电池结构如下图:
以下选项两栏内容正确且相关联的是
| 选项 |
操作与现象 |
解释与推论 |
| A |
电池放电时化学能转化为电能 |
Zn(s) + Cu2+(aq) = Zn2+ + Cu(s) △H>0 |
| B |
该电池充电时铜棒变细 |
两电极区溶液颜色都变深 |
| C |
该电池放电时铜棒是电池正极 |
Cl-通过交换膜从左(铜棒区)向右(锌棒区)移动 |
| D |
该电池充电时a接电源正极 |
电极反应Cu2++2e- = Cu |
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图。下列说法正确的是
| A.此电池在常温时也能工作 |
| B.正极电极反应式为:O2+2CO2+4e﹣=2CO32﹣ |
| C.CO32﹣向正极移动 |
| D.a为CH4,b为CO2 |
丙烷(C3H8)和丙烯(C3H6)都可作火炬燃料。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)=CH4(g)+HC CH(g)+H2(g) △H1=+156.6 kJ·mol-1
CH(g)+H2(g) △H1=+156.6 kJ·mol-1
CH3CH CH2(g)=CH4(g)+HC
CH2(g)=CH4(g)+HC CH(g ) △H2=+32.4 kJ·mol-1
CH(g ) △H2=+32.4 kJ·mol-1
则相同条件下,反应C3H8(g)= CH3CH CH2(g)+H2(g)的△H= kJ·mol-1。
CH2(g)+H2(g)的△H= kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池负极反应式为 ;放电时CO32-移向电池的 (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1= 。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= 。(已知10-5.60=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中:
①c(OH-)= 。
②c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)。
一种基于酸性燃料电池原理设计的酒精检测仪,电池反应的化学方程式为:
CH3CH2OH+O2=CH3COOH+H2O。下列有关说法不正确的是
| A.检测时,电解质溶液中的H+向正极移动 |
| B.若有0.4mol电子转移,则消耗2.24L氧气 |
| C.正极上发生还原反应,负极上发生氧化反应 |
| D.负极上的反应为:CH3CH2OH-4e-+H2O=CH3COOH+4H+ |
镁—次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg +ClO - +H2O ="=" Mg(OH)2+ Cl-下列有关说法正确的是
| A.电池工作时,C溶液中的溶质是MgCl2 |
| B.电池工作时,正极a附近的pH将不断增大 |
| C.负极反应式:ClO -—2e - +H2O ="=" Cl- + 2OH- |
| D.a电极发生还原反应,每转移0.2mol电子,理论上生成0.1mol Cl- |
微型纽扣电池在现代生活中是广泛应用的一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式分别为:Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-,电池总反应式为Ag2O+Zn===2Ag+ZnO。根据上述反应式,判断下列叙述中正确的是
| A.在使用过程中,电池负极区溶液pH增大 |
| B.在使用过程中,电子由Ag2O极经外电路流向Zn极 |
| C.在使用过程中,Zn电极发生还原反应,Ag2O电极发生氧化反应 |
| D.外电路中每通过0.2 mol电子,正极的质量理论上减小1.6 g |