天津市武清区高三质量调查(三)化学试卷
下列说法正确的是
| A.HClO2 →ClO2+Cl2+H2O(未配平), 1 mol HClO2分解时转移电子的物质的量为1 mol |
| B.标准状况下,14 g CO、C2H4混合气体与11.2 L N2所含有的分子数都是0.5NA |
| C.与金属Cu常温下反应放出气体的溶液可以存在的离子有:Fe2+、Al3+、SO42-、K+ |
D.在燃煤时加入适量石灰石,可减少SO2的排放,其中发生的反应为2CaCO3 +O2+2SO2 2CaSO3 +2CO2 2CaSO3 +2CO2 |
综合下图判断,下列叙述不正确的是
| A.Ⅰ、Ⅱ的反应原理均是Zn + Cu2+ = Zn2+ + Cu |
| B.Ⅰ、Ⅱ中均有电子转移,均是把化学能转化为电能利用 |
| C.随着反应的进行,Ⅰ、Ⅱ中CuSO4溶液颜色均渐渐变浅 |
| D.取a中溶液,加足量Ba(NO3)2溶液,过滤后向滤液中加AgNO3溶液,有沉淀产生 |
在100℃时,将N2O4、NO2分别充入两个各为1 L的密闭容器中,反应过程中浓度变化如下:
[2NO2(g) N2O4(g) ΔH<0]
N2O4(g) ΔH<0]
| 容器 |
物质 |
起始浓度/(mol·L-1) |
平衡浓度/(mol·L-1) |
| Ⅰ |
N2O4 |
0.100 |
0.040 |
| NO2 |
0 |
0.120 |
|
| Ⅱ |
N2O4 |
0 |
0.014 |
| NO2 |
0.100 |
0.072 |
下列说法正确的是
A.平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4)<α(NO2)
B.平衡时,Ⅰ、Ⅱ中上述正反应的平衡常数K(Ⅰ) = 2K(Ⅱ)
C.平衡后,升高相同温度,以N2O4表示的反应速率ν(Ⅰ)<ν(Ⅱ)
D.平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2(或K[Al(OH)4])的混合溶液中,生成沉淀与通入CO2的量的关系可表示为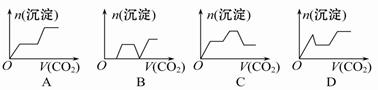
迷迭香酸具有抗氧化、延缓衰老、减肥降脂等功效,它的结构简式为 ,以邻苯二酚为原料合成迷迭香酸的路线为
,以邻苯二酚为原料合成迷迭香酸的路线为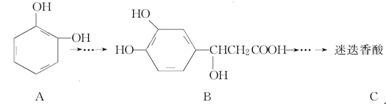
下列说法正确的是
| A.有机物B可以发生取代、加成、消去、氧化反应 |
| B.有机物A分子中所有原子一定在同一平面上 |
| C.有机物C在浓硫酸催化下水解的一种产物是B |
| D.1 mol B与足量的NaOH溶液反应,最多可消耗4 mol NaOH |
A、B、C、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、C同周期,A、D同主族,A、C常温下能形成两种液态化合物A2C和A2C2,E元素的周期数与主族序数相等。
请用化学用语回答下列问题:
(1)E元素在周期表中的位置为____________,请写出E最高价氧化物对应水化物的电离方程式:_________________________________。
(2)C、D、E三种元素对应简单离子半径从大到小的顺序为_____>_____>_____;
由A、B、C三种元素组成的18电子微粒的分子式为______________________。
(3)用电子式表示BC2的形成过程:_________________________________。
(4)原子序数比C小1的元素F,也能与A形成18电子的分子,已知1 mol该分子在一定条件下可以还原4 mol氧化铜,同时生成一种无污染的气体单质和红色固体还有水。请写出化学方程式_____________。
(5)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式:___________。
(6)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA, DA能与水反应放出氢气,若将1 mol DA和1 mol E单质混合加入足量的水,充分反应后生成的气体在标准状况下的体积是_________L。
芳香酯类化合物A、B互为同分异构体,均含C、H、O三种元素。相同状况下,A、B蒸气对氢气的相对密度是97,分子中C、H原子个数相同,且C、H原子数之和是O原子数的5倍。
(1)A的分子式是________________。已知:各有机物间存在如下转化关系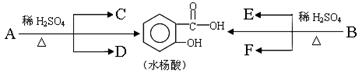
其中C能发生银镜反应,F经连续氧化可生成C;C与D是相对分子质量相同的不同类型的有机物。
(2)水杨酸中所含官能团的名称是____________;完全燃烧时,1 mol D与1 mol 下列有机物耗氧量相同的是____________(填字母代号)。
a.C3H6O3 b.C3H8O c.C2H4 d.C2H6O2
(3)B的结构简式是________________________;
水杨酸与小苏打溶液反应的化学方程式:___________________________;一定条件下,C与F反应的反应类型是____________。
(4)写出C与足量银氨溶液的反应化学方程式______________;反应类型是____________。
(5)同时符合下列要求的化合物有____________种。
①与A互为同分异构体
②可以水解
③苯环上有两个取代基,且苯环上的一氯代物只有1种
(6)1 mol上述(5)中的一种有机物X 在水溶液中,能与4 mol NaOH共热发生反应,写出此反应的化学方程式:____________________________________。
铁及其化合物在日常生活中很常见
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
回答下列问题:
①操作II所包含的两项主要基本操作是 。上述流程中,Fe(OH)2转化成Fe(OH)3时的化学方程式为 。
②将FeCl2溶液高温水解、氧化也可直接制得氧化铁,请写出反应的化学方程式: 。
(2)有些同学认为用KMnO4溶液能进行绿矾(FeSO4·7H2O)产品中铁元素含量的测定,反应的离子方程式为: ,该滴定过程中 (填“是”或“否”)还需要指示剂。
实验步骤如下:
a.考虑绿矾产品可能因为保存不当被空气中氧气所氧化,所以事先取少量绿矾产品溶于水,滴加 溶液进行验证。
b.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
c.量取25.00mL待测溶液于锥形瓶中;
d.用硫酸酸化的0.01000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
请完成下列问题:
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 。
②某同学设计的下列滴定方式,最合理的是________(夹持部分略去)(填字母序号)。
③计算上述样品中FeSO4·7H2O的质量分数为 。
丙烷(C3H8)和丙烯(C3H6)都可作火炬燃料。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)=CH4(g)+HC CH(g)+H2(g) △H1=+156.6 kJ·mol-1
CH(g)+H2(g) △H1=+156.6 kJ·mol-1
CH3CH CH2(g)=CH4(g)+HC
CH2(g)=CH4(g)+HC CH(g ) △H2=+32.4 kJ·mol-1
CH(g ) △H2=+32.4 kJ·mol-1
则相同条件下,反应C3H8(g)= CH3CH CH2(g)+H2(g)的△H= kJ·mol-1。
CH2(g)+H2(g)的△H= kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池负极反应式为 ;放电时CO32-移向电池的 (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1= 。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= 。(已知10-5.60=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中:
①c(OH-)= 。
②c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号