近几年科学家发明的一种新型可控电池——锂水电池,工作原理如图所示。下列有关说法不正确的是
| A.碳极发生的反应是:2H2O+2e-=H2↑+2OH- |
| B.有机电解质和水溶液不可以互换区域 |
| C.标况下产生22.4L的氢气时,正极消耗锂的质量为14g |
| D.该装置不仅可提供电能,还可得到清洁的氢气 |
下列说法中正确的是
| A.镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池 |
| B.燃料电池是一种高效但是会污染环境的新型电池 |
| C.化学电池的反应基础是氧化还原反应 |
| D.铅蓄电池放电的时候正极是Pb负极是PbO2 |
金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度。它无电时也无需充电,只需更换其中的某些材料即可,其工作示意图如下,下列说法正确的是
| A.放电时,空气极为负极 |
| B.放电时,电池反应为:4Li+O2=2Li2O |
| C.有机电解液可以是乙醇等无水有机物 |
| D.在更换锂电极的同时,要更换水性电解液 |
有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的是
| A.电极a的反应式为:CH4+4O2--8e-=CO2+2H2O |
| B.电极b是正极,O2-由电极a流向电极b |
| C.瓦斯分析仪工作时,电池内电路中电子由电极a流向电极b |
| D.当固体电解质中有1 mol O2-通过时,电子转移4 mol |
化学镀铜废液中含有一定量的CuSO4,任意排放会污染环境,利用电化学原理可对废液进行回收处理,装置如图,其中质子交换膜只允许H+通过。已知:①Cu2++ HCHO + 3OH-=Cu + HCOO-+ 2H2O;②还原性:HCHO > M(—种金属)> Cu。
下列说法正确的是
| A.反应之前,应将含OH-的HCHO溶液加人到装置的左侧 |
| B.右侧发生的电极反应式:HCHO-2e-+H2O=HCOO-+3H+ |
| C.若将质子交换膜换成阴离子交换膜,放电过程中,大量的OH-将向左侧迁移 |
| D.放电一段时间后打开开关,移去质子交换膜,装置中可能会有红色固体、蓝色絮状物出现 |
电动汽车具有绿色、环保等优点,镍氢电池(NiMH)是电动汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金,电池中主要以KOH作电解液。该电池在充电过程中的总反应方程式是:Ni(OH)2+M=NiOOH+MH。下列有关镍氢电池的说法中正确的是
| A.充电过程中OH-离子从阳极向阴极迁移 |
| B.充电过程中阴极的电极反应式:H2O+M+e一=MH+OH-,H2O中的H被M还原 |
| C.电池放电过程中,正极的电极反应式为:NiOOH+H2O+e-= Ni(OH)2+OH- |
| D.电池放电过程中,负极附近的溶液pH增大 |
全固态锂硫电池是一种新型电池,其能且密度约为一般电子设备中广泛使用的锂离子电池的4倍,且成本更低廉.已知锂硫电池的总反应为2Li+S Li2S,用此电池作电源电解足量的AgNO3溶液,其工作原理如下图所示。下列有关说法正确的是
Li2S,用此电池作电源电解足量的AgNO3溶液,其工作原理如下图所示。下列有关说法正确的是
| A.乙池溶液中的NO3一移向铁电极 |
| B.乙池石墨电极反应式为Ag++e-=Ag |
| C.甲池充电时,锂电极发生氧化反应 |
| D.甲池中消耗14g锂,乙池中产生11.2L氧气《标准状况下) |
水系锂电池具有安全、环保和价格低廉等优点成为当前电池研究领域的热点。以钒酸钠(NaV3O8)为正极材料的电极反应式为:NaV3O8+xLi++xe-= NaLixV3O8,则下列说法不正确的是
A.放电时,负极的电极反应式:Li-e- Li+ Li+ |
| B.充电过程中Li+从阳极向阴极迁移 |
| C.充电过程中阳极的电极反应式为NaLixV3O8-xe-=NaV3O8+xLi+,NaLixV3O8中钒的化合价发生变化 |
| D.该电池可以用硫酸钠溶液作电解质 |
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。下列说法正确的是
| A.电池放电时Na+从b极区移向a极区 |
| B.该电池的负极反应为:BH4-+8OH--8e-===BO2-+6H2O |
| C.电极a采用MnO2,MnO2既作电极材料又有催化作用 |
| D.每消耗3 mol H2O2,转移的电子为3 mol |
高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述正确的是
| A.放电时,负极反应式为3Zn-6e-+6OH-===3Zn(OH)2 |
| B.放电时,正极区溶液的pH减小 |
| C.充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原 |
| D.充电时,电池的锌电极接电源的正极 |
铅蓄电池的工作原理为:Pb + PbO2 + 2H2SO4====2PbSO4 + 2H2O
研读下图,下列判断不正确的是
| A.K闭合时,d电极反应式:PbSO4 + 2H2O-2e--==== PbO2 + 4H+ +SO |
| B.当电路中转移0.2mol电子时,I中消耗的 H2SO4为0.2 mol |
| C.K闭合时,II中SO向c电极迁移 |
| D.K闭合一段时间后,II可单独作为原电池,d电极为正极 |
(13分)有A、B、C、D、E、F、G、H八种原子序数依次增大的元素(原子序数均小于30)。A原子的核外电子数与电子层数相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,A、E同主族,F的基态原子s能级的电子总数与p能级的电子数相等,B、G同族,H的基态原子的3d轨道电子数是4s电子数的4倍。请回答下列问题:
(1)H元素在周期表中属于 区。G的基态原子电子排布式为 CD2中C的杂化类型是___________
(2)下列说法不正确的是 。
a.B2A2分子中含有σ键和π键
b.B2A2分子的沸点明显低于A2D2分子
c.A2D2分子的空间构型为直线形
d.B、C、D的电负性由大到小的顺序为D>C>B
e.B、C、D的第一电离能由大到小的顺序为D>C>B
f.H2+能与BD分子形成[H(BD)4]2+,其原因是BD分子中含有空轨道
g.B和G的单质能形成相同类型的晶体,其熔点B > G
(3)由B、F、H三种元素形成的一种具有超导性的晶体,B位于F和H原子紧密堆积所形成的空隙当中。晶胞如图所示,该晶体的化学式为___________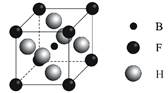
(4)CD2、D2和熔融ECD3可制作燃料电池,其原理如下图所示。该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,石墨Ⅰ电极反应式为___________
新一代锂电池的反应为: FePO4 + Li LiFePO4该电池可用于电动汽车,其以含 Li+的导电固体为电解质。下列有关LiFePO4 电池说法正确的是
LiFePO4该电池可用于电动汽车,其以含 Li+的导电固体为电解质。下列有关LiFePO4 电池说法正确的是
| A.放电时电池正极反应为: FePO4 + Li+ + e- =LiFePO4 |
| B.充电时LiFePO4只发生氧化反应不发生还原反应 |
| C.充电过程中, 电池正极材料的质量增加 |
| D.加入硫酸可以提高电解质的导电性 |
镁—次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+ H2O + 2e-=Cl-+ 2OH-,关于该电池的叙述正确的是
| A.该电池中镁为负极,发生还原反应 |
| B.电池工作时,OH-向正极移动 |
| C.电池工作时,正极周围溶液的pH将不断变小 |
| D.该电池的总反应为:Mg + ClO-+ H2O=Mg(OH)2↓+ Cl- |
甲醇来源丰富,价格低廉,是一种重要的化工原料,有着非常重要、广泛的用途。工业上通常用水煤气在恒容、催化剂和加热的条件下生产甲醇,其热化学方程式为:
2H2(g)+CO(g) CH3OH(g) ΔH=-90.8kJ/mol。
CH3OH(g) ΔH=-90.8kJ/mol。
(1)该反应的平衡常数表达式为:K= ,如升高温度,K值将 (填:增大、减小或不变)。
(2)以下各项不能说明该反应达到平衡状态的是 .
A、混合气体的密度保持不变 B、甲醇的质量分数保持不变
C、CO的浓度保持不变 D、2v逆(H2)=v正(CH3OH)
(3)在2100C、2400C和2700C三种不同温度、2L恒容密闭容器中研究合成甲醇的规律。
上图是上述三种温度下不同的H2和C0的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线Z对应的温度是 。由起始达到a点所需时间为5min,则H2的反应速率 mol/(L·min)。
(4)某兴趣小组设计了如图所示的甲醇燃料电池装置。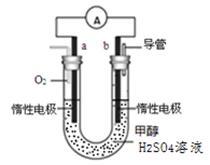
①该电池工作时,正极是 极(填“a”或 “b”);
②该电池负极反应的离子方程式为 。