(15分)如图所示的装置,X、Y都是惰性电极。将电路接通后,向(乙)中滴人酚酞溶液,在Fe极附近显红色。试回答下列问题:
(1)(甲)装置是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是_______(填“CH4”或“O2”),b处电极上发生的电极反应式是____;
(2)在(乙)装置中,石墨(C)电极上发生_______反应(填“氧化”或“还原”);(乙)装置中总反应的离子方程式是:___________________________________.
(3)如果(丙)装置中精铜电极的质量增加了6.4g,则(乙)装置中,铁电极上产生的气体在标准状况下为____,(甲)装置中消耗的 CH4的质量为____。
(4)(丁)装置中X电极为_______极(填“正”、“负”、“阳”、“阴”),在通电一段时间后,Y电极上发生的电极反应式是_______。
一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示。以下说法不正确的是
| A.中间室Cl—移向左室 |
| B.X气体为CO2 |
| C.处理后的含硝酸根废水pH降低 |
| D.电路中每通过1 mol电子,产生标准状况下氮气的体积为2.24L |
全钒氧化还原液流电池是一种新型电能储存和高效转化装置,该电池是将具有不同价态的钒离子溶液分别作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为V2+-e-====V3+,下列说法正确的是
| A.放电时,右槽发生还原反应 |
| B.放电时,左槽电解液pH升高 |
| C.充电时,阴极的电极反应式:VO2++2H++e-====VO2++H2O |
| D.充电时,每转移1 mol电子,n(H+)的变化量为1 mol |
(12分)有机反应中常用镍作催化剂,某化工厂收集的镍催化剂中含Ni 64.0%,Al 24.3%、Fe 1.4%,其余为SiO2和有机物。这些含镍废催化剂经乙醇洗涤后可按下列工艺流程回收镍:
已知:部分阳离子以氢氧化物形式完全沉淀时的pH如下:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
| pH |
5.2 |
3.2 |
9.7 |
9.2 |
请回答下列问题:
(1)滤液A中存在的阴离子主要是______。
(2)硫酸浸取滤渣a后,所得滤液B中可能含有的金属离子是__________。
(3)滤液B中加入H2O2的目的是_______________。操作X的名称是 。
(4)含镍金属氢化物MH-Ni燃料电池是一种绿色环保电池,广泛应用于电动汽车。其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液。它的充、放电反应为:xNi(OH)2+M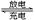 MHx+xNiOOH
MHx+xNiOOH
电池充电过程中阳极的电极反应式为 ,放电时负极的电极反应式为 。
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
下列叙述不正确的是
| A.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化 |
| B.充电时阳极反应为:Fe(OH)3 — 3e-+ 5 OH-= FeO42-+ 4H2O |
| C.放电时正极附近溶液的碱性增强 |
| D.放电时负极反应为:Zn — 2e- +2OH- = Zn(OH)2 |
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH= -196.6kJ·mol-1
2SO3(g) ΔH= -196.6kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH= -113.0kJ·mol-1
2NO2(g) ΔH= -113.0kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
| A.体系压强保持不变 | B.混合气体颜色保持不变 |
| C.SO3和NO的体积比保持不变 | D.每消耗1molSO3的同时生成1mol NO |
测得上述反应达平衡时NO2与SO2的体积比为5∶1,则平衡常数K= 。
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
1.3×104kPa左右,选择此压强的理由是: 。
(3)依据燃烧的反应原理,合成的甲醇可以设计如图(3)所示的原电池装置。
① 该电池工作时,OH-向 极移动(填“正”或“负”)。
② 该电池正极的电极反应式为 。
如图是一种可充电的锂离子电池充、放电的工作示意图。放电时该电池的电极反应式为:负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)正极:Li1-xMnO2+xLi++x e-=LiMnO2(LiMnO2表示含锂原子的MnO2)下列有关说法正确的是
A.该电池的反应式为: |
| B.K与M相接时,A是阳极,发生氧化反应 |
| C.K与N相接时,Li+由A极区迁移到B极区 |
| D.在整个充电或放电过程中都只存在一种形式的能量转化 |
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池的说法中正确的是
| A.在熔融电解质中O2-由负极移向正极 |
B.电池的总反应是2C4H10+13O2 8CO2+10H2O 8CO2+10H2O |
C.通入空气的一极是正极,电极反应为:O2+4e-+2H2O 4OH- 4OH- |
D.通入丁烷的一极是正极,电极反应为:C4H10-26e-+13O2- 4CO2+5H2O 4CO2+5H2O |
甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料。以CH4和H2O为原料制备甲醇和二甲醚的工业流程如下:
根据要求回答下列问题:
(1)“反应室1”在一定条件下反应的化学方程式为 。
(2)水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g) ΔH = -90.8kJ·mol-1
CH3OH(g) ΔH = -90.8kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH = -23.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH = -23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH = -41.3kJ·mol-1
CO2(g)+H2(g) ΔH = -41.3kJ·mol-1
完成热化学反应方程式:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g);ΔH = 。
CH3OCH3(g)+CO2(g);ΔH = 。
(3)某科研机构研制的一种新型的质子交换膜二甲醚燃料电池(DDFC),该电池有较高的安全性。该电池总反应为CH3OCH3+3O2=2CO2+3H2O,其工作原理如图所示。
电极a的电极反应式为 。
(14分)A、B、C、D、E、F均为短周期元素,其原子序数依次增大。已知:A的最外层电子数等于其电子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素。根据以上信息回答下列问题:
(1)B与D形成化合物BD2的结构式为 。
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式 。FD2气体通入BaCl2和甲的混合溶液,生成白色沉淀和无色气体CD,有关反应的离子方程式为_____。
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为____________________________________;由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示)_______________。
(4)C2A4─空气燃料电池是一种碱性燃料电池。电解质溶液是20%~30%的KOH溶液。则燃料电池放电时:正极的电极反应式是______________;负极的电极反应式为 。
目前机动车使用的电池品种不少,其中铅蓄电池的使用量最大。
I.铅蓄电池的电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。铅蓄电池充放电的总反应方程式为:
PbO2+Pb+2H2SO4 2PbSO4+2H2O,请根据上述情况判断:
2PbSO4+2H2O,请根据上述情况判断:
(1)电池的负极材料是 。
(2)充电时,铅蓄电池阳极的电极反应式为 。
Ⅱ.铅蓄电池使用量的急速增加引起铅污染日益严重,工业上从废铅蓄电池的铅膏回收铅的一种工艺流程如下:
请回答下列问题:
(3)为提高步骤①的化学反应速率,你认为可采取的措施是 (写一条即可)。
(4)写出步骤①中PbSO4转化为PbCO3反应的平衡常数表达式:K = 。
(5)步骤①中发生氧化还原反应的化学方程式为 。
(6)步骤③从母液可获得的副产品为 (写化学式)。
(7)已知:PbCO3在一定条件下可制得PbO,PbO通过进一步反应可制得Pb,写出一个由PbO生成Pb的化学方程式: 。
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是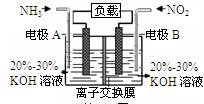
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.A电极上发生氧化反应,B为正极 |
| C.电极A极反应式为2NH3-6e-=N2+6H+ |
| D.当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol |
铜在工农业生产中有着广泛的用途。
(1)配制CuSO4溶液时需加入少量稀H2SO4,其原因是 (只写离子方程式)。
(2)某同学利用制得的CuSO4溶液,进行以下实验探究。
①图甲是根据反应Fe+CuSO4=Cu+FeSO4设计的原电池,请在图甲中的横线上完成标注。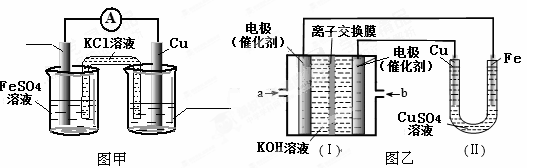
②图乙中,I是甲烷燃料电池的示意图,该同学想在II中实现铁上镀铜,则应在a处通入 (填“CH4”或“O2”),b处电极上发生的电极反应式为 ;若把II中电极均换为惰性电极,电解液换为含有0.1molNaCl溶液400mL,当阳极产生的气体为448mL(标准状况下)时,溶液的pH= (假设溶液体积变化忽略不计)。
(3)电池生产工业废水中常含有毒的Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去[室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2]。请结合离子方程式说明上述除杂的原理:当把FeS加入工业废水中后, 直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+。
请仔细观察下列三种装置的构造示意图。根据要求回答问题: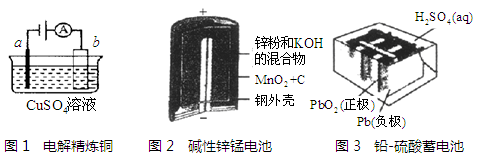
(1)电解精炼铜(如图1)时,b极材料是________(填“纯铜”或“粗铜”);其电解质溶液能否用CuCl2替代?答:________(“能”或“否”)。
(2)碱性锌锰电池(如图2)的总反应式为Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2,该电池的负极反应式为______________________。若有0.65g锌参与了电池反应,则转移电子的物质的量为 mol。
(3)铅-硫酸蓄电池(如图3)放电过程中,负极的电极反应式为 ,充电时,Pb电极应接电源的______极(填“正极”或“负极”)。