宁夏银川市普通高中高三四月教学质量检测理综化学试卷
下列说法正确的是
| A.厨房中用的食盐、食醋都是电解质 |
| B.古代的陶瓷、砖瓦、现代的玻璃、水泥等,都是硅酸盐产品 |
| C.石油的分馏、煤的干馏、石油的裂解都是化学变化 |
| D.工业上通过电解熔融的氯化物制取Na、Mg、Al三种金属 |
下列说法正确的是
| A.淀粉、纤维素和油脂都是天然高分子化合物 |
| B.乙酸乙酯在碱性条件下的水解反应称为皂化反应 |
| C.乙醇能使酸性高锰酸钾溶液褪色,发生的是氧化反应 |
| D.乙烯可以与氢气发生加成反应,苯不能与氢气加成 |
设NA为阿伏伽德罗常数的数值,下列说法正确的是
| A.常温常压下,14 g C2H4、C3H6的混合气体中含有碳原子的数目为NA |
| B.常温下,pH=12的Na2CO3溶液中含有的OH-离子数为0.01NA |
| C.标准状况下,0.56 L丙烷中含有共价键的数目为0.2 NA |
| D.7.8 gNa2O2中含有的阴离子数为0.2NA |
下列反应的离子方程式正确的是
| A.向明矾溶液中加入足量的烧碱溶液: Al3++3OH-=Al(OH)3 ↓ |
B.在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入稀盐酸:3Fe2++4H++NO =3Fe3++NO↑+2H2O =3Fe3++NO↑+2H2O |
C.碳酸氢铵溶液中滴加足量的NaOH溶液:HCO +OH-=CO +OH-=CO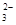 +H2O +H2O |
D.纯碱溶液呈碱性的原因:CO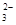 +H2O +H2O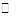 HCO HCO +OH- +OH- |
一种基于酸性燃料电池原理设计的酒精检测仪,电池反应的化学方程式为:
CH3CH2OH+O2=CH3COOH+H2O。下列有关说法不正确的是
| A.检测时,电解质溶液中的H+向正极移动 |
| B.若有0.4mol电子转移,则消耗2.24L氧气 |
| C.正极上发生还原反应,负极上发生氧化反应 |
| D.负极上的反应为:CH3CH2OH-4e-+H2O=CH3COOH+4H+ |
下列说法不正确的是
A.常温下,在0.1mol·L-1的HNO3溶液中,由水电离出的c(H+)<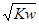 |
B.浓度为0.1mol·L-1的NaHCO3溶液:c(H2CO3)>c(CO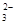 ) ) |
| C.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同 |
| D.冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
“霾”是当今世界环境热点话题。目前宁夏境内空气质量恶化原因之一是机动车尾气和燃煤产生的烟气。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
2NO(g)+2CO(g)  2CO2(g)+N2(g) △H=-a kJ·mo1-1(a>0)
2CO2(g)+N2(g) △H=-a kJ·mo1-1(a>0)
(1)在一定温度下,将2.0mol NO、2.4mol CO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示:

①0~15minN2的平均速率v(N2)= ;NO的转化率为 。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是 (选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将 移动(选填“向左”、“向右”或“不”),重新达到平衡后,该反应的化学平衡常数为 。
(2)己知:2NO(g)+O2(g)=2NO2(g) △H=-bkJ·mol-1(b>0)
CO的燃烧热△H=-CkJ·mol-1(c>0)
则在消除汽车尾气中NO2的污染时,NO2与CO发生反应的热化学反应方程式为: 。
(3)工业废气中含有的NO2还可用电解法消除。制备方法之一是先将NO2转化为N2O4,然后采用电解法制备N2O5,装置如图所示。Pt乙为 极,电解池中生成N2O5的电极反应式是 。

废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下:

已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。

请回答下列问题:
(1)加入ZnO调节pH=a的目的是 ,a的范围是 。
(2)由不溶物E生成溶液D的化学方程式为 。
(3)滤液A中加入H202反应的离子方程式为 。
(4)由溶液D制胆矾晶体包含的主要操作步骤是 。
(5)下列试剂可作为Y试剂的是 。
| A.ZnO | B.NaOH | C.Na2CO3 | D.ZnSO4 |
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是 。
氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与氢氧化钠溶液反应)中A1N的含量,某实验小组设计了如下两种实验方案。
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案l】取一定量的样品,用以下装置测定样品中AIN的纯度(夹持装置已略去)。

(1)上图C装置中球形干燥管的作用是 。
(2)完成以下实验步骤:组装好实验装置,首先 ,再加入实验药品。接下来的实验操作是 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是 。
(3)若去掉装置B,则导致测定结果 (填“偏高”、“偏低”或“无影响”)。由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见 。
【方案2】按以下步骤测定样品中A1N的纯度:

(4)步骤②生成沉淀的离子方程式为 。
(5)步骤③的操作是 。A1N的纯度是 (用m1、m2表示)。
水处理技术在生产、生活中应用广泛。
(1)根据水中Ca2+、:Mg2+的多少,把天然水分为硬水和软水,硬水必须经过软化才能使用。
①硬水软化的方法通常有 、 和离子交换法。离子交换树脂使用了一段时间后,逐渐由NaR型变为CaR2(或MgR2)型,而失去交换能力。把CaR2(或MgR2)型树脂置于 中浸泡一段时间,便可再生。
②当洗涤用水硬度较大时,洗衣粉与肥皂相比, 洗涤效果较好,原因是 。
(2)工业上常用绿矾做混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理的水pH调到9左右,再加入绿矾。请解释这一做法的原因: 。(用必要的离子方程式和文字描述)。
(3)最近我国某地苯胺大量泄漏于生活饮用水的河道中,当地采取的应急措施之一是向河水中撒入大量的活性炭,活性炭的作用是 。
已知A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素。E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子。
(1)基态E原子的价电子排布图 。
(2)B、C、D三元素第一电离能由大到小的顺序为 (用元素符号表示).
(3)BD 中心原子杂化轨道的类型为 杂化;CA4+的空间构型为 (用文字描述)。
中心原子杂化轨道的类型为 杂化;CA4+的空间构型为 (用文字描述)。
(4)1mol B一中含有 键的数目为 NA。
键的数目为 NA。
(5)D、E元素最简单氢化物的稳定性 > (填化学式),理由是 .
(6)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,C原子的配位数是 。若相邻C原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为 g/cm3(用含a、NA的符号表示)。

丰富多彩的现代生活离不开香料,香豆素是一种重要的有机香料。实验室合成香豆素的路径如下:

(1)香豆素的分子式为 ,(Ⅳ)中含氧官能团的名称 .
(2)(I)与H2反应生成邻羟基苯甲醇,邻羟基苯甲醇的结构简式为 。
(3)反应①、②的反应类型依次是 .
(4)反应④的化学方程式是 .
(5)V是(Ⅳ)的同分异构体,V的分子中含有苯环且无碳碳双键,苯环上含有两个邻位取代基,且能够发生酯化反应和银镜反应。则V的结构简式为 (任写一种)。
(6)一定条件下, 与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为 .
与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为 .

 粤公网安备 44130202000953号
粤公网安备 44130202000953号