已知外电路中,电子由铜流向a极。有关下图所示装置的分析中,合理的一项是
| A.一段时间后Zn电极逐渐溶解 |
| B.该装置中Cu极为正极,发生还原反应 |
| C.b极反应的电极反应式为:H2-2e-=2H+ |
D.电流方向: |
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”。特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如右图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2 C6+LiCoO2。下列说法不正确的是
C6+LiCoO2。下列说法不正确的是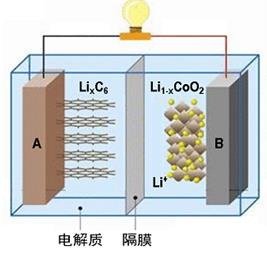
| A.据题意分析可知该隔膜只允许Li+通过,放电时Li+从左边流向右边 |
| B.放电时,正极锂的化合价未发生改变 |
| C.充电时B作阳极,该电极放电时的电极反应式为:Li1-x CoO2+ xLi++ xe-= LiCoO2 |
| D.废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 |
(16分)运用化学原理知识研究化学对于人类的生产生活、科研意义重大。
(1)工业上以黄铜矿(主要成分:CuFeS2,其中S为-2价)为原料,采用火法熔炼工艺生产粗铜。CuFeS2中Fe的化合价为_____,熔炼过程中所得炉渣的主要成分有FeO、Fe2O3、SiO2,Al2O3等,若要利用炉渣制取铁红,下列实验操作不需要的是_____(填写字母代号)。
| A.溶解 | B.过滤 | C.蒸发结晶 | D.灼烧 |
(2)Mg(OH)2是水垢的主要成分之一,用氯化铵溶液浸泡:可以溶解Mg(OH)2,请结合平衡移动原理解释其原因_____。
(3)研究发现CuCl2溶液中铜、氯元素的存在形式为Cu(H2O)42+、CuCl42-,电解CuCl2溶液一段时间,阳极产生2.24L(标准状况)黄绿色气体,阴极析出红色物质,试计算该过程中共转移电子____mol,若要使电解质溶液恢复至原浓度,应向电解后的溶液中加入________。
(4)以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2。其工作原理如图所示。电池放电时Na+由____(填写“a”或“b”,下同)极区移向___________极区,该电池的负极反应式为__________________________________。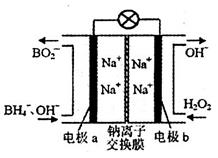
某课外活动小组设想:如果模拟工业上离子交换膜法制烧碱的方法,利用下图实验装置(两电极均为石墨电极)电解 溶液来制取
溶液来制取 、
、 、
、 和NaOH,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念。
和NaOH,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念。
(1)该电解槽的阳极反应式为 ,此时通过阴离子交换膜的离子数 (填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
(2)制得的 溶液从出口 (填“A”、“B”、“C”或“D”)导出。
溶液从出口 (填“A”、“B”、“C”或“D”)导出。
(3)利用制得的氢气为基本原料合成出甲醇,然后再用甲醇与氧气、氢氧化钠组成燃料电池,则该电池负极的电极反应式为 。
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法正确的是
A.该电池的负极反应为   |
| B.电池放电时Na+从b极区移向a极区 |
| C.每消耗3 mol H2O2,转移的电子为3 mol |
| D.电极a采用MnO2作电极材料 |
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH
溶液,其充、放电过程按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2,
Cd(OH)2 + 2Ni(OH)2,
有关该电池的说法正确的是
| A.充电时阳极反应:Ni(OH)2-e—+ OH—="=" NiOOH + H2O |
| B.充电过程中镉元素被氧化 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH—向正极移动 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛使用,锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应为:ZN(s)+2MNO2(s)+H2O(l)﹦ZN(OH)2(s)+MN2O3(s)。下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MNO2(s)+H2O(l)+2e-﹦MN2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
甲烷燃料电池以铂丝为电极,KOH为电解质溶液,从两极分别通入甲烷和氧气即可产生电流。关于此燃料电池的下列叙述正确的是
| A.通入CH 4的电极为正极 |
| B.正极的电极反应式为:2O2 +8e - +4H2O=8OH- |
| C.若甲烷通入量为1.12 L(标准状况)且反应完全,则电池中有0.1 mol O 2被氧化 |
| D.通入甲烷的电极的电极反应式为:CH 4 +2O 2 + 4e - =CO 2+ 2H2O |
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。下图为RFC工作原理示意图,有关说法正确的是
A.当有0.1 mol电子转移时,a极产生标准状况下1.12 L H2
B.左端装置中化学能转化为电能,右端装置中电能转化为化学能
C.c极上发生的电极反应是:O2+2H2O+4e-===4OH-
D.d极上发生氧化反应,右端装置B中的H+可以通过隔膜进入A
某二次电池充、放电的化学方程式为:2K2S2+KI3 K2S4+3KI。与其它设备连接的电路如图示。当闭合开关K时,X附近溶液先变红。则下列说法正确的是
K2S4+3KI。与其它设备连接的电路如图示。当闭合开关K时,X附近溶液先变红。则下列说法正确的是
| A.K+从右到左通过离子交换膜 |
| B.A的电极反应式为:3I--2e-= I3- |
| C.当有0.1 mol K+通过离子交换膜,X电极上产生气体1.12 L(标准状况下) |
| D.电池充电时,B电极要与外电源的正极相连,电极上发生还原反应 |
下面是某课外小组从初选后的方铅矿【主要成分PbS,含少量黄铜矿(CuFeS2)中提取硫磺、铜、铅的工艺流程: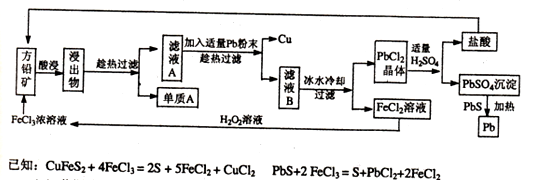
(1)黄铜矿(CuFeS2 )中Fe元素的化合价为 ,提高方铅矿酸浸效率的措施有 (写出两种方法即可)。
(2)过滤过程中用到的玻璃仪器有烧杯、玻璃棒、 ;单质A是 ;在此工艺操作中可循环利用的物质有铅和
(3)在酸性的FeC12溶液中加入H202溶液,其反应的离子方程式为 。
(4)PbS04与PbS加热条件下反应的化学方程式为. .将沉淀PbSO4与足量的碳酸钠溶液混合,沉淀可转化为PbCO3,写出该反应的平衡常数表达式:K= 。(己知Ksp(PbSO4)="1.6x" 10-5,Ksp(PbC03)=3.3x10-14)
(5)铅蓄电池的电极材料分别是Pb和PbO2,电解质溶液为硫酸。铅蓄电池充放电的总反应方程式为:PbO2+Pb+2H2SO4 2PbS04+2H20,充电时,铅蓄电池阳极的电极反应式为 。
2PbS04+2H20,充电时,铅蓄电池阳极的电极反应式为 。
我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐。下列说法正确的是
| A.a为正极 |
| B.左池电极反应式为C6H6O+11H2O-28e-=6CO2↑+28H+ |
| C.若右池产生0.672L气体(标况下),则转移电子0.15mol |
| D.左池消耗的苯酚与右池消耗的NO3-的物质的量之比为28:5 |
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是
| A.正极反应式:Ag+Cl﹣﹣e﹣=AgCl |
| B.每生成1mol Na2Mn5O10转移2mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |
甲醇、氧气和强碱溶液作电解质的手机电池中的反应为2CH3OH+3O2+4OH- 2CO32- +6H2O,有关说法正确的是
2CO32- +6H2O,有关说法正确的是
| A.充电时化学能转化为电能 |
| B.放电时,负极电极反应式为:CH3OH + 8OH-- 6e-=CO32- + 6H2O |
| C.标况下,通入的11.2L氧气完全反应有1mol电子转移 |
| D.充电时电解质溶液的碱性逐渐减小 |