河北省唐山市高三第二次模拟考试理综化学试卷
下列描述正确的是
A.硝酸的标签上应标注 |
B.硫离子结构示意图 |
C.HC10的电子式: |
| D.239Pu比235U原子核内多4个中子 |
下列物质在给定条件下同分异构体数目正确的是
| A.C4H10属于烷烃的同分异构体有3种 |
| B.分子组成是C5H10O2属于羧酸的同分异构体有5种 |
| C.分子组成是C4H80属于醛类的同分异构体有3种 |
D.结构为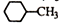 的一溴代物有5种 的一溴代物有5种 |
短周期主族元素X, Y, Z在周期表中的位置如右图。下列说法正确的是
| A.Z元素的最高化合价一定大于X元素 |
| B.三种元素原子半径由高到低的顺序一定是Y>X>Z |
| C.若它们的原子最外层电子数之和为11,则X为金属元素 |
| D.若它们均为金属元素,则Y的最高价氧化物对应水化物的碱性最强 |
用下列装置进行相应实验、能达到实验目的的是
| A.图1所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 |
| B.图2所示装置用于除去碳酸氢钠固体中的少量碳酸钠 |
| C.图3所示装置配制100 mL 0.1 mol-L-1的硫酸 |
| D.图4所示装置用于分离出溴苯 |
下列说法正确的是
A.在Na2S溶液中: |
B.乙烯的燃烧热为 ,则乙烯燃烧的热化学方程式可表示为: ,则乙烯燃烧的热化学方程式可表示为: |
C.钢铁发生吸氧腐蚀的正极反应式为: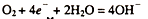 |
D.从酸化的海带灰浸出液中提取碘: |
煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为:C(s)+2H2(g) CH4(g)
CH4(g)
在VL的容器中投入a mol碳(足量),同时通入a mol H2,控制条件使其发生上述反应,实验测得H2的平衡转化率随压强及温度的变化关系如图所示。下列说法正确的是
| A.上述逆反应为吸热反应 |
B.在5MPa, 800K时,该反应的平衡常数为 |
C.在4MPa, 1200K时,图中X点 |
| D.工业上维持6 MPa、1000K而不采用10 MPa、1000K,主要是因为前者氢气的转化率高 |
下面是某课外小组从初选后的方铅矿【主要成分PbS,含少量黄铜矿(CuFeS2)中提取硫磺、铜、铅的工艺流程: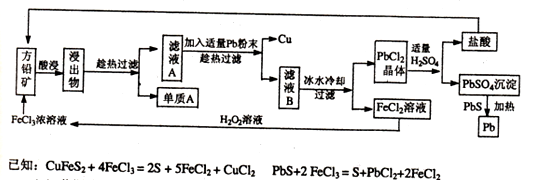
(1)黄铜矿(CuFeS2 )中Fe元素的化合价为 ,提高方铅矿酸浸效率的措施有 (写出两种方法即可)。
(2)过滤过程中用到的玻璃仪器有烧杯、玻璃棒、 ;单质A是 ;在此工艺操作中可循环利用的物质有铅和
(3)在酸性的FeC12溶液中加入H202溶液,其反应的离子方程式为 。
(4)PbS04与PbS加热条件下反应的化学方程式为. .将沉淀PbSO4与足量的碳酸钠溶液混合,沉淀可转化为PbCO3,写出该反应的平衡常数表达式:K= 。(己知Ksp(PbSO4)="1.6x" 10-5,Ksp(PbC03)=3.3x10-14)
(5)铅蓄电池的电极材料分别是Pb和PbO2,电解质溶液为硫酸。铅蓄电池充放电的总反应方程式为:PbO2+Pb+2H2SO4 2PbS04+2H20,充电时,铅蓄电池阳极的电极反应式为 。
2PbS04+2H20,充电时,铅蓄电池阳极的电极反应式为 。
(14分)丁酸异戊酯又称香蕉油,多用于食品和化妆品的香精,实验室用正丁酸与异戊醇反应制备丁酸异戊酯,有关数据和装置示意图如下:
实验步骤:
①如图连接好装置,在三颈烧瓶中加入0.2 mol异戊醇和0.1 mol正丁酸、数滴浓硫酸、5 ML苯和2-3片碎瓷片。充分摇匀,分水器内加入异戊醇直至与支管相平;
②在122-.132℃下回流反应1.5 h即可得粗产品;
③冷却后用10%的NaOH溶液中和,用水洗至中性,加入无水硫酸镁后蒸馏得较纯净的丁酸异戊酷11 g.
回答下列问题:
(1)图中A仪器的名称是 ,冷却水应从 (选择a或b)口进。
(2)在该实验中,三颈烧瓶的容积最适合的是 (填入正确选项前的字母)。
A.50 mL B.100 ML C.200 mL
(3)加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是 (填入正确选项前的字母)。
A.冷却后补加 B.立即补加 C.不需补加 D.重新配料
(4)加入过量异戊醇的目的是 ,分离提纯过程中加入无水硫酸镁的目的是 。
(5)在蒸馏得较纯净的丁酸异戊酯操作中,仪器选择及安装都正确的是 (填标号)。
(6)本实验的产率是 。(保留三位有效数字)
(15分)“优先反应思想”是一条重要的化学学科思想。根据所学知识及题目提供的相关数据,回答下列问题:
(1)向FeBr2溶液中滴加少量氯水,溶液变黄。你认为使溶液变黄的微粒其符号是用实验证明你的观点,简述实验操作及现象 。
(2)用惰性电极电解由等物质的量的NaBr,KI, NaCl组成的混合溶液,阳极首先发生的电极反应式是 。
(3)己知常温下一些电解质的相关数据见下表: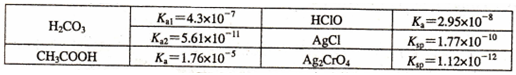
①向等物质的量浓度的Na2C03, CH3COONa, NaClO组成的混合溶液中逐滴加入稀硫酸,首先发生反应的离子方程式是 。
②向浓度均为0.010 mol/L的NaCl, Na2Cr04组成的混合溶液中逐滴加入浓度为0.010 mol-L -1AgN03溶液,首先生成的沉淀其化学式为 。
(4)分别向四份各100 ML,浓度均为2 mo1-L-1的FeC13溶液中,加入铁、铜组成的均匀粉末状混合物,得到如下数据:
①根据表中的数据可求出粉末中铁、铜的物质的量之比为 。
②根据表中的数据分析I反应后的溶液中存在的金属阳离子有〔用离子符号表示) 。
[化学一选修2化学与技术」磷单质及其化合物有广泛应用。
(1)磷酸二氢钙,广泛用于动物的饲料添加剂。目前其制备的新工艺方法有:石灰法:用石灰石中和磷酸,控制终点PH为3.2,即得磷酸二氢钙。请写出该反应的化学方程式 ;若有1x103kg石灰石最多能生产 kg磷酸二氢钙。
(2)用石英、焦炭与磷灰石[主要成分Ca5(P04)3F]在高温下制备黄磷(P4)的化学方程式为: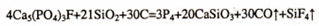 在此反应中,副产物矿渣可用来 。
在此反应中,副产物矿渣可用来 。
(3)三聚磷酸可视为三个磷酸分子(磷酸结构简式如图 )之间脱去两个水分子的产物,其结构简式为 。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 。
)之间脱去两个水分子的产物,其结构简式为 。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 。
(4)次磷酸钠(NaH2P02)可用于化学镀镍。化学镀镍的溶液中含有Ni2+和H2P02在酸性条件下发生下述反应:请配平该离子方程式。
(5)H3P02可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):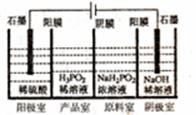
①写出阳极的电极反应式 。
②分析产品室可得到H3P02的原因 。
[化学—选修3物质结构与性质】(巧分)已知A, B、C、D, E, F为元素周期表前四周期原子序数依次增大的六种元素,其中A的一种同位素原子中无中子,B的一种核素在考古时常用来鉴定一些文物的年代,D与E同主族,且E的原子序数是D的2倍,F元素在地壳中的含量位于金属元素的第二位。试回答下列问题:
(l)F元素的价层电子排布式为 。
(2)关于B2A2的下列说法中正确的是 (填选项序号)。
①B2A2中的所有原子都满足8电子稳定结构
②B2A2是由极性键和非极性键构形成的非极性分子
③每个B2A2分子中 键和
键和 键数目比为1:1
键数目比为1:1
④B2A2分子中的A-B键属于 键
键
(3)B,C,D三种元素第一电离能按由大到小的顺序排列为 (用元素符号表示) B、C、D三种元素中与BD2互为等电子体的分子式为 (用元素符号表示)
(4)A2E分子中心原子的杂化类型为_____。比较A2D与A2E分子的沸点,其中沸点较高的原因为 。元素D可形成两种同素异形体,其中在水中溶解度更大的是 (填分子式)。
(5) F单质的晶体在不同温度下有两种堆积方式,信息如下:
则方式I与方式II中F原子配位数之比为 ,晶体密度之比为 。
【化学一选修S有机化学基础t】(15分)己知G是一种高分子塑料, 在酸性条件下水解生成M和N:
在酸性条件下水解生成M和N:
用N制取G的流程如下:
请回答下列问题:
(1)化合物E中所含两种官能团的名称是 .
(2)己知F的分子式为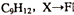 的反应类型是 。若F分子中核磁共振氢谱的峰面积之比为1:1:2:2:6写出F的结构简式 。
的反应类型是 。若F分子中核磁共振氢谱的峰面积之比为1:1:2:2:6写出F的结构简式 。
(3)N转化为X的化学方程式为 。E转化为G的化学方程式为 。
(4)化合物M不能发生的反应是 (填字母代号)。
a.加成反应
b.缩聚反应
c.消去反应
d.醋化反应
e.水解反应
f.置换反应
(5)同时符合下列三个条件的M的同分异构体有 种(不考虑立体异构)。
I、含有间二取代苯环结构II.属于酯 III.与FeC13溶液发生显色反应。写出其中不含甲基的一种同分异构体的结构简式

 粤公网安备 44130202000953号
粤公网安备 44130202000953号