期中备考总动员高三化学模拟卷【江苏】8
室温时,关于下列溶液的叙述正确的是
| A.1.0×10—3mol/L盐酸的pH=3,1.0×10—8mol/L盐酸的pH=8 |
| B.pH=a的醋酸溶液稀释l倍后,溶液的pH=b,则a>b |
| C.pH=12的氨水和pH=2的盐酸等体积混合,混合液的pH<7 |
| D.1mLpH=l的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 |
【原创】下列所述溶液中,一定可以大量共存的离子组是
| A.PH=3的溶液中: Na+、Fe2+、SO42-、NO3- |
| B.无色的弱碱性溶液中: K+、Na+、ClO-、SO42- |
| C.含有大量Cl-的溶液中: NH4+、Na+、SiO32-、HCO3- |
| D.水电离产生的c(OH-)=1×10-10mol/L的溶液中: Al3+、SO42-、NO3-、Cl- |
【改编】下列物质性质与应用对应关系正确的是
| A.加碘盐中含有碘元素,所以可以用淀粉检验真伪 |
| B.苏打具有弱碱性,可用于治疗胃酸过多引起的胃痛 |
| C.分子晶体中一定存在共价键 |
| D.铝热反应可以用来焊接钢轨 |
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是
| A.用装置甲制取氯气 |
| B.用装置乙除去氯气中的少量氯化氢 |
| C.用装置丙分离二氧化锰和氯化锰溶液 |
| D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O |
【改编】用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.室温下,48.0 gO2和O3的混合气体中含有的氧原子数目为1.5NA |
| B.取2.5L 3.2 mol·L-1NaHCO3溶液 ,所得溶液含有8 NA个HCO3- |
| C.25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的Ba2+的数目为0.1NA |
| D.标准状况下,2.24 L Cl2通入足量FeCl2溶液反应,溶液颜色变黄,转移的电子总数为0.2NA |
【改编】下列反应的离子方程式正确的是
| A.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2 = 2Fe3++Br2+4Cl- |
B.服用阿司匹林过量出现水杨酸( )中毒反应,可静脉注射NaHCO3溶液: )中毒反应,可静脉注射NaHCO3溶液: + 2 HCO3- → + 2 HCO3- → + 2 CO2↑ + 2 H2O + 2 CO2↑ + 2 H2O |
| C.强碱溶液中NaClO与Fe(OH)3反应:3ClO—+2Fe(OH)3=2FeO42—+3Cl—+H2O+4H+ |
D.FeCl3溶液中通入适量SO2,溶液黄色褪去:2Fe3++SO2 +2H2O  2Fe2+ + SO42—+ 4H+ 2Fe2+ + SO42—+ 4H+ |
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法不正确的是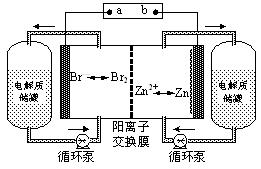
| A.充电时电极a连接电源的负极 |
| B.放电时负极的电极反应式为Zn—2e-=Zn2+ |
| C.放电时左侧电解质储罐中的离子总浓度增大 |
| D.阳离子交换膜可阻止Br2与Zn直接发生反应 |
【原创】元素X、Y、Z、L、W、H的原子序数依次增大,如图所示,下列叙述正确的是
| X |
|
|
||||||||||||||||
| |
|
|
|
|
|
|
|
|
|
|
|
|
Y |
|
L |
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Z |
|
|
| W |
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A.原子半径:H>W>Z>Y>L>X
B.元素Y 、L和 Z形成的气态氢化物稳定性Z>L>Y
C.H原子的电子排布为[Ar]3d8
D.元素W 、Z的最高价氧化物的水化物可以反应,且生成物既含有离子键又含有共价键
用H2O2和H2SO4的混合溶液可溶解废旧印刷电路板上的铜。已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=" +64.39" kJ·mol -1
2H2O2(l)═2H2O(l)+O2(g)△H= -196.46 kJ·mol -1
H2(g)+ 1/2O2(g)═H2O(l))△H=-285.84 kJ·mol -1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H2O(l)的反应热△H等于
| A.-417.91 kJ·mol -1 | B.-319.68 kJ·mol -1 |
| C.+546.69 kJ·mol -1 | D.-448.46 kJ·mol -1 |
某温度下,对于反应N2(g)+3H2(g)  2NH3(g) ;△H=-92.4kJ/mol。
2NH3(g) ;△H=-92.4kJ/mol。
N2的平衡转化率(α)与体系总压强(P)的关系如右图所示。下列说法正确的是:
A.将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ
B.平衡状态由A变到B时,平衡常数K(A) < K(B)
C.上述反应在达到平衡后,增大压强,H2的转化率提高
D.保持压强不变,通入惰性气体,平衡常数不变,平衡不移动
新型纤维酸类降脂药克利贝特可由物质X在一定条件下反应制得:
下列有关叙述正确的是
| A.克利贝特的分子式为C28H36O6 |
| B.物质X分子中所有碳原子可能位于同一平面内 |
| C.1 mol物质X最多可以与含2 molBr2的溴水反应 |
| D.用饱和NaHCO3溶液可以鉴别物质X和克利贝特 |
【原创】下列实验操作设计合理的是
| A.用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,说明该溶液一定不存在K+ |
| B.Cl2中混有少量HCl:通过盛有饱和食盐水的洗气瓶 |
| C.向某溶液中滴加硝酸酸化的Ba(NO3)2溶液产生白色沉淀,说明该溶液中含有SO42- |
| D.加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用 |
14.25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是
| A.在0.1 mol·L-1Na2S溶液中:2c(Na+) =c(S2-)+c(HS-) +c(H2S) |
| B.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+ c(H+)= c(OH-)+c(CH3COO-) |
| C.向0.1 mol·L-1盐酸与0.1 mol·L-1K2CO3溶液等体积混合:c(K+) >c(Cl-)>c(HCO3-)>c(OH-)>c(H+) |
| D.向0.1 mol·L-1NH4HSO4溶液中滴加NaOH至溶液恰好呈中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-) =c(H+) |
下图是可逆反应X2 + 3Y2 2Z2在反应过程中的反应速率(υ)与时间(t)的关系曲线,下列叙述正确的是
2Z2在反应过程中的反应速率(υ)与时间(t)的关系曲线,下列叙述正确的是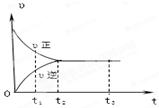
| A.t1时,只有正方向反应 | B.t2时,反应到达限度 |
| C.t2~ t3,反应不再发生 | D.t2~t3,各物质的浓度一定相等 |
某科研小组以难溶性钾长石(K2O•Al2O3•6SiO2)为原料,提取Al2O3、K2CO3等物质,工艺流程如下:

(1)煅烧过程中钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式是: 。
(2)已知NaAlO2和KAlO2易发生如下水解反应:AlO2—+ 2H2O Al(OH)3 + OH— ,
Al(OH)3 + OH— ,
“浸取”时应保持溶液呈 性(填“酸”或“碱”)。
(3)“转化”时加入NaOH的主要作用是 (用离子方程式表示)。
(4)上述工艺中可以循环利用的主要物质是 、 和水。
(5)以Al2O3为原料,以石墨为电极,通过电解法可制得金属铝。电解池中接电源负极的一极的电极反应式是 。长时间电解后,需要更换新的石墨电极的是 极(填“阴”或“阳”)。
已知两个羟基同时连在同一个碳原子上时结构是不稳定的,它将发生脱水反应,例如:CH3CH(OH)2→CH3CHO +H2O,现有分子式为C9H8O2Br2的物质M,已知E的化学式为C7H5O2Na,A的相对分子质量为46,在一定条件下可发生下列一系列反应:

请回答下列问题
(1)B中官能团的名称 ,A的核磁共振氢谱有 个吸收峰;G→H的反应类型 。
(2)M的结构简式
(3)写出下列反应的化学方程式
①E→F ②H→I
(4)同时符合下列条件的G的同分异构体的结构简式有 种,写出其中一种
| A.分子中含有苯环 | B.能发生水解反应 |
| C.能发生银镜反应 | D.与FeCl3溶液反应显紫色 |
碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·x H2O]常用作塑料阻燃剂。
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和 。
(2)MgaAlb(OH)c(CO3)d·x H2O中a、b、c、d的代数关系式为 。
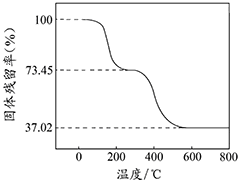
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390g样品与足量稀盐酸充分反应,生成CO20.560L(已换算成标准状况下)。
②另取一定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如图所示(样品在2700C时已完全失去结晶水,6000C以上残留固体为金属氧化物的混合物)。
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-): n(CO32-)(写出计算过程)。
甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解。Ⅰ、实验室制取的方法之一是:Ca(OH)2 +2HCHO + H2O2 = Ca(HCOO)2 + 2H2O + H2↑。
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1∶2∶1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品。
(1)过氧化氢比理论用量稍多,其目的是 。
(2)反应温度最好控制在30-70℃之间,温度不易过高,其主要原因是 。
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是 。
(4)实验时需强力搅拌45min,其目的是 ;结束后需调节溶液的pH 7~8,其目的是 。最后经结晶分离、干燥得产品。
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙。结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算),现提供的试剂有:a.甲酸钠,b.5mol·L-1硝酸,c. 5mol·L-1盐酸,d. 5mol·L-1硫酸,e. 3%H2O2溶液,f.澄清石灰水。
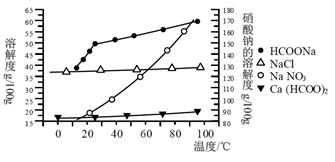
请补充完整由碳酸钙制备甲酸钙的实验步骤
| 金属离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1. 1 |
3. 2 |
| Al3+ |
3. 0 |
5. 0 |
| Fe2+ |
5. 8 |
8. 8 |
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶待用,并称取研细的碳酸钙样品10g待用。
步骤2. 。
步骤3. 。
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、 、洗涤、60℃时干燥得甲酸钙晶体。
【改编】常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
①五种盐均溶于水,E盐溶液为黄色其余水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、E的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,B、E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C的溶液中,均能生成不溶于稀硝酸的沉淀。
⑦分别加热五种盐溶液,无使湿润红色石蕊试剂变蓝的气体生成。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是____________;一定含有的阳离子有_________________________所含阴离子相同的两种盐的化学式是__________________。
(2)D的化学式为__________________,D溶液与B溶液混合后生成沉淀和气体(用离子方程式表示)____________________________________________
(3)A和C的溶液反应的离子方程式是______________________________________;C和氨水反应生成无色溶液的离子方程式是____________________________________________。
(4)高中阶段检验E中阳离子的方法是__________________________________________向E溶液中加入适量铁粉,溶液颜色改变,其离子方程式为____________________________________。
选做(12分)(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式 。
(2)富勒烯衍生物由于具有良好的光电性能。富勒烯(C60)的结构如图1,分子中碳原子轨道的杂化类型为 ;1 mol C60分子中σ键的数目为 。科学家把C60和K掺杂在一起制造出的化合物具有超导性能,其晶胞如图2所示。该化合物中的K原子和C60分子的个数比为 。

(3)砷化镓是人工合成的新型半导体材料,其晶体结构与金刚石相似。
①GaAs晶体中,每个As与 个Ga相连。
②第一电离能:As Se(填“>”、“<”或“=”)。
(4)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ,与其互为等电子体的一种分子为 。
选做[实验化学]甲苯氧化法制备苯甲酸的反应原理如下:
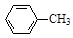 + 2KMnO4
+ 2KMnO4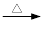
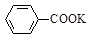 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
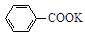 + HCl
+ HCl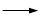
 +KCl
+KCl
实验时将一定量的甲苯和KMnO4溶液置于图1装置中,在100 ℃时, 反应一段时间,再停止反应,并按如下流程分离出苯甲酸和回收未反应的甲苯。

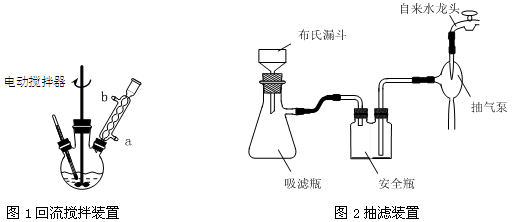
(1)实验室中实现操作Ⅰ所需的玻璃仪器有 、烧杯;操作Ⅱ的名称为 。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,若无此操作会出现的危害是 。
(3)在操作Ⅲ中,抽滤前需快速冷却溶液,其原因是 ;如图2所示抽滤完毕,应先断开 之间的橡皮管。
(4)纯度测定:称取1.220 g产品,配成100 mL溶液,取其中25.00 mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3 mol。产品中苯甲酸质量分数为 。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号