现有下列物质:
①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸
⑤FeCl3溶液 ⑥铜 ⑦ Fe(OH)3胶体 ⑧蔗糖,
(1)其中属于电解质的是 ,
(2)写出FeCl3的电离方程式:__________________________,
(3)写出NaHCO3(aq) 与稀盐酸反应的离子方程式:_____________________,
(4)胶体是一种常见的分散系,回答下列问题。
①向煮沸的蒸馏水中逐滴加入饱和FeCl3溶液,继续煮沸至溶液呈红褐色,
停止加热,可制得Fe(OH)3胶体,制取Fe(OH)3胶体化学反应方程式为 。
②向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于_______离子(填离子符号)的作用,使胶体形成了沉淀,这个过程叫做胶体的聚沉。
③区分胶体和溶液常用的方法叫做 。
氧化剂和还原剂在生产生活中广泛使用。
(1)高锰酸钾和氢溴酸溶液可以发生如下反应:
2KMnO4+ 16HBr = 5Br2+ 2MnBr2+ 2KBr+ 8H2O
①其中还原剂为 ,还原产物为
②若有0.8 mol还原剂被氧化,则转移电子的物质的量是
(2)双氧水H2O2可作为矿业废液消毒剂,可以消除采矿业废液中的氰化物(如KCN,其中N为﹣3价),化学方程式为:KCN+H2O2+H2O═KHCO3+A↑(已配平)
①生成物A的化学式为
②用双线桥法表示该反应中电子转移的方向和数目:
(3)古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:
NaClO+ NH3·H2O  N2H4 + NaCl+ H2O
N2H4 + NaCl+ H2O
①请配平上述化学方程式
②NH3·H2O在上述反应中显示出来的性质是
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
(4)人体内所含铁元素以Fe2+和Fe3+的形式存在市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为 ,但Fe2+在酸性条件下很容易被空气中的氧气氧化,写出该反应的离子方程式
在一定条件下可实现下图所示物质之间的变化:

请填写以下空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解。写出其分解的化学方程式_____________ _____。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式:____________________。
(3)写出过量F通入A中生成沉淀的离子方程式:______________。
(4)每生成1 mol D(固体),同时生成_________mol E。
(1)下列物质中,能导电的是 ,属于电解质的是 (填序号)。
①Cu、②液氨、③氯化钠晶体、④硫酸溶液、⑤干冰、⑥BaSO4、⑦金刚石.
(2)将等物质的量的①Na、②Na2O、③Na2O2、④NaOH投入相同质量的水中,所得溶液浓度由大到小的顺序为 。如果将等物质的量换成等质量则 。(填序号)
(3)用氯化铝溶液与氢氧化钠溶液反应时,当Al3+离子的物质的量与OH-离子的物质的量之比(以下均填物质的量之比)为__________或________时Al(OH)3沉淀量为最多沉淀量的1/4。
(1)写出下列离子方程式相应的化学方程式
①Ca2++CO32-=CaCO3↓ 化学方程式_____________
②Cu2++Fe ="Cu" +Fe2+ 化学方程式_____________
(2)鉴别饱和碳酸钠溶液和澄清石灰水,可选用的试剂有(填编号)________
A.盐酸 B.NaCl溶液 C.BaCl2溶液
(1)在标准状况下,CO和CO2混合气体的密度是相同条件下H2密度的16倍,则该混合气体的平均相对分子质量为______________ ;若在该条件下混合气体的物质的量为1mol,则其中CO所占的体积为______________ ,CO2所占的质量为__________________ 。
(2)NaHSO4在水中的电离方程式: ___________;
若将NaHSO4与Ba(OH)2在溶液中按物质的量2:1混合,反应的离子方程式是______________
围绕下列七种物质:①铝、②Al2O3、③稀硝酸、④H2SO4、⑤Ba(OH)2固体、⑥稀氨水、⑦Al2(SO4)3、⑧NaOH溶液,按要求回答下列问题:
(1)既能与强酸反应,又能与强碱反应的是_____________(填序号);
(2)属于电解质的是_____________(填序号);
(3)写出最适宜制取Al(OH)3的离子方程式_____________;
(4)两物质间发生反应的离子方程式为H++OH-=H2O,请写出该反应的化学方程式_____________;
(5)写出①和⑧反应的离子方程式________________________;
(6)34.2g⑦溶于水配成500mL溶液,则溶液中SO42-的物质的量浓度为_____________。
按要求完成以下化学方程式:(是离子反应的只写离子方程式)
(1)铁在氯气中燃烧____________________________;
(2)将二氧化硫气体通入足量的澄清石灰水中__________________________;
(3)工业上氨在催化剂作用下与氧气反应__________________________;
(4)钠与硫酸铜溶液反应_______________、___________;
写出下列过程所发生反应的离子方程式
(1)用400 mL 0.5 mol·L-1的NaOH溶液吸收8.96 g SO2气体: 。
(2)将过量铝粉投入NaOH溶液: 。
(现有以下物质:①NaOH溶液 ②液氨 ③BaCO3固体 ④熔融KHSO4 ⑤Fe(OH)3胶体 ⑥铜⑦CO2 ⑧CH3COOH
(1)以上物质中属于混合物的是____________(填序号)
以上物质中属于非电解质的是____________(填序号)
(2)对物质⑤进行通电,观察到阴阳两极的现象是____________
以上纯净物中能导电的是___________(填序号)
(3)写出①和⑧的水溶液反应的离子方程式____________
(4)写出④的电离方程式____________
(5)在足量④的水溶液中加入少量③,发生反应的离子方程式为____________
(6)在含0.4mol①的溶液中缓慢通入标准状况下6.72LCO2,气体被完全吸收,则反应后的溶质有___________(填化学式),该过程总的离子反应方程式为____________
化学学习活动小组学习了铁铜化合物知识后,查阅资料,积极思考,提出了一系列问题,请予以解答:
(1)氯化亚铜(CuCl)是重要的化工原料,工业上常通过下列反应制备CuCl
2CuSO4+Na2SO3+2NaCl+Na2CO3===2CuCl↓+3Na2SO4+CO2↑
查阅资料可得,CuCl可以溶解在FeCl3溶液中,请写出该反应的离子方程式是
(2) 已知:Cu2O在酸溶液中发生歧化反应:Cu2O+2H+==Cu2+ +Cu +H2O
现将一定量混合物(Fe2O3、Cu2O、CuCl、Fe)溶解于过量稀盐酸中,反应完全后,得到W(包括溶液和少量剩余固体),此时溶液中一定含有的阳离子 (用离子符号表示);继续往W中通入足量的氯气,不断搅拌,充分反应,溶液中哪些离子的物质的量一定有明显变化 (用离子符号表示);不通入气体,改往W中加入过量铁粉,过滤,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2mol I-时,共转移3 mol电子,该反应的离子方程式是 。
已知H2CO3的Ka1=4.2×10-7、Ka2=5.6×10-11;HClO的Ka="3.0×" 10-8,
HF的Ka=3.5×10-4。
(1)NaClO溶液中通入少量CO2发生反应的离子方程式为 。
(2)在饱和氯水中加入NaHCO3,直至溶液的黄绿色褪去,则发生反应的离子方程式为 。
(3)常温下,将pH和体积都相同的氢氟酸和次氯酸分别加蒸馏水稀释,pH随溶液体积变化如图所示。

①曲线Ⅰ为 稀释时pH的变化曲线。
②取A点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗 体积较小。
(4)25 ℃时,将0.40 mol·L-1 HCN溶液与0.20 mol·L-1 NaOH溶液各100 mL混合后,测得溶液的pH=a(a>7)。则该溶液中所有离子浓度大小关系为 ;
c(HCN)-c(CN-)= mol·L-1。(假设混合后体积等于两种溶液体积之和)
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置为 ,四氧化三铁可写成FeO·Fe2O3 的形式,如果将Pb3O4也写成相对应的形式应为: 。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为: 。
PbO2可有PbO与次氯酸钠溶液反应制得,其反应的离子方程式为 。
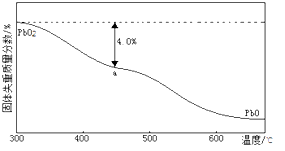
(3)PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%(即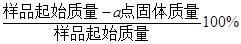 )的残留固体,若a点固体组成表示为PbO2或mPbO2 ·nPbO,计算x值和m:n , 。
)的残留固体,若a点固体组成表示为PbO2或mPbO2 ·nPbO,计算x值和m:n , 。
现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题。
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。主要反应为:
2ZnS +3O2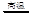 2ZnO+2SO2;鼓风炉中:2C +O2
2ZnO+2SO2;鼓风炉中:2C +O2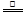 2CO ZnO+CO
2CO ZnO+CO Zn + CO2
Zn + CO2
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2
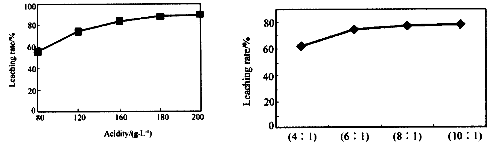
图1酸度对铟浸出率的影响 图2液固比对铟浸出率的影响
①当酸度为196时,其物质的量浓度为 。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:_______、_______。
(2)湿法炼锌的主要工艺流程为:

①从保护环境和充分利用原料角度,如何处理或利用烟气 。
②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式 。
③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式__________、__________。