工业上以废铜为原料经一系列化学反应可生产氯化亚铜(CuCl),其工艺流程如图所示:
试根据如图转化回答下列问题:
(1)工业生产Cl2时,尾气常用石灰乳吸收,而不用烧碱溶液吸收的原因是__________。
(2)还原过程中的产物为Na[CuCl2],试写出反应的化学方程式__________,制备中当氯化完成后必须经还原过程再制得CuCl,为什么不用一步法制得CuCl?(已知Cu2++Cu+2Cl-═2CuCl↓) __________。
(3)还原过程中加入少量盐酸的作用是__________,加入NaCl且过量的原因是__________。
(4)合成结束后所得产品用酒精淋洗的目的是__________。
(5)实验室中在CuCl2热溶液中通入SO2气体也可制备白色的CuCl沉淀,试写出该反应的离子方程式__________。
根据要求回答下列各题:
Ⅰ.现有①Na2O ②SO3 ③铁 ④蔗糖 ⑤冰醋酸(纯醋酸晶体) ⑥KNO3晶体 ⑦氢氧化钠溶液等物质,请填空回答(填序号):
以上物质在常温下(1)能导电的是 ;
(2)属于非电解质的是 ;
(3)属于电解质的是 。
Ⅱ.离子反应为中学化学中重要反应类型,在发生离子反应的反应物或生成物中,一定存在下列________(填序号)
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
烟气中主要污染物为SO2、NO、NO2,可用如下工艺进行脱硫脱硝及产物回收。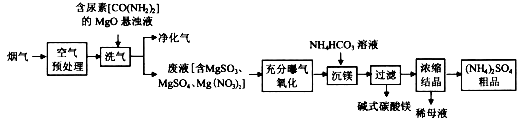
(1)空气预处理过程中,发生主要反应的化学方程式为____________________________。
(2)洗气过程中,尿素作还原剂,转化成两种无污染的气体是_________________(填化学式)。
(3)充分曝气氧化过程中,发生反应的化学方程式为___________________。
(4)完成沉镁过程中生成碱式碳酸镁[MgCO3∙Mg(OH)2]的离子方程式
______Mg2++______= MgCO3∙Mg(OH)2↓+______CO2↑+______H2O
(5)(NH4)2SO4粗品中含有的主要杂质为__________(填名称)。
(6)碱式碳酸镁经过简单加工可循环利用,加工过程发生反应的化学方程式为________________。
有四种物质:①Al2O3、②HNO3、③NaHCO3、④Ba(OH)2。根据要求,回答下列问题:
(1)写出物质④的电离方程式_______________________________。
(2)写出物质②和③反应的离子方程式_______________________________。
(3)既能与强酸反应,又能与强碱反应的物质是____________(填序号)。
有NaHSO4、Ba(OH)2、NaHCO3三种溶液,已知其中两种溶液的物质的量浓度相同,且分别为另一种溶液的物质的量浓度的2倍;若先将 NaHSO4和NaHCO3溶液各100mL混合反应后,再加入Ba(OH)2溶液100mL,充分反应后,将生成的白色沉淀滤出,得300mL滤液,测得滤液中只含NaOH溶质,其物质的量的浓度为 0.9 mol·L-1(不考虑混合时引起的溶液体积的变化),试回答下列问题:
(1)写出Ba(OH)2溶液与过量NaHCO3溶液反应的离子方程式: ;
(2)写出NaHSO4溶液和NaHCO3溶液反应的离子方程式: ;
(3)通过分析,判断原Ba(OH)2、NaHSO4、NaHCO3三种溶液中哪两种溶液的物质的量浓度不可能相同?(填化学式)。
(4)题中NaHCO3溶液的浓度可能为 。
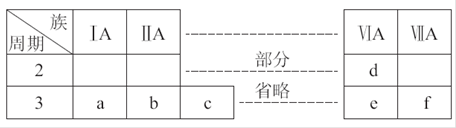
(1)画出b元素的原子结构示意图 ,并写出元素b的单质在二氧化碳中燃烧的化学方程式: 。
(2)将a、b、c三种元素的最高价氧化物对应的水化物碱性由强到弱排序: (填写物质化学式)。
(3)写出元素c的氧化物与元素a的最高价氧化物对应的水化物反应的离子方程式: 。
(4)将e、f的最高价氧化物对应的水化物酸性较强的是: (填写物质化学式)。
(5)写出d元素的氢化物(一个分子共有三个原子)电子式: ,写出f元素与该氢化物反应的离子方程式: 。
①HCl、②过氧化钠、③碳酸氢钠、④二氧化硅是常见的物质。请回答下列问题。
(1)上述4种物质中属于盐的是 (填序号,下同);上述四种物质加入紫色石蕊溶液中,溶液变红的是 。
(2)写出HCl的电离方程式 。
(3)写出过氧化钠与水反应的化学方程式___________________________。
(4)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为______________。
(5)写出二氧化硅与氢氧化钠溶液反应的化学方程式_______________________。
有下列物质:①H2SO4;②金属铜;③Al2O3;④漂白粉;⑤蔗糖;⑥醋酸;⑦NO;⑧SiO2。
(1)请用序号填写空白:以上物质中属于混合物的是____________;能导电的是____________;属于弱电解质的是____________;能引起光化学烟雾的是____________;属于两性氧化物的是 ;可用作光导纤维原料的是 。
(2)写出H2SO4在水中的电离方程式: 。
(3)写出Al2O3溶于NaOH溶液的离子方程式:____________。
按要求完成下列各题。
(1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为: 。
(2)ClO2常用子水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式: 。
(3)MnO2可与KOH和KClO3在高温条件下反应,生成K2MnO4,反应的化学方程式为: 。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为 。
(4)(CN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为 。
无机化合物可根据其组成和性质进行分类:

(1)上述所示的物质分类方法名称是 。
(2)以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②、③和⑥后面。(每空填写一个化学式即可)
| 物质类别 |
酸 |
碱 |
盐 |
氧化物 |
| 化学式 |
①HCl ② |
③ ④Ba(OH)2 |
⑤Na2CO3 ⑥ |
⑦CO2 ⑧Na2O2 |
(3)二氧化碳与氢氧化钠溶液反应的离子方程式为____________。
(4)过氧化钠可作供氧剂,原因是_______(用化学方程式表示)。
氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:

回答下列问题:
(1)步骤①溶解温度应控制在60~70度,原因是_____________,加入硝酸铵的作用是_____________。
(2)写出步骤③中主要反应的离子方程式_______________。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_____________(写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是 。
(5)准确称取所制备的氯化亚铜样品m g,将其置于若两的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为__________。
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:氧化性:  ; KI+I2
; KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、 Fe3+),用适量蒸 馏水溶解,并加稀盐酸酸化,将所得溶液分为2份。
第一份试液中滴加 KSCN溶液后显红色;
第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;
①加KSCN溶液显红色,写出生成红色物质的离子方程式是 ;CCl4中显紫红色的物质是___________________(用电子式表示)(1分)。
②第二份试液中加入足量KI固体后,反应的离子方程式为:
IO3-+5I-+6H+==3I2+3H2O 和 _______ ______。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境下KI与氧气反应的化学方程式:______ ________。将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?______(填“是”或“否”),并说明理由__________________。
某化学实验室产生的废液中含有Fe3+、Cu2+、Ba2+、Cl-四种离子,现设计下列方案对废液进行处理,以回收金属并制备氯化钡、氯化铁晶体。

(1)沉淀1中含有的金属单质是 。
(2)氧化时加入H2O2溶液发生反应的离子方程式为 。
(3)下列物质中,可以作为试剂X的是 (填字母)。
| A.BaCl2 | B.BaCO3 | C.NaOH | D.Ba(OH)2 |
(4)检验沉淀2洗涤是否完全的方法是 。
(5)制备氯化铁晶体过程中需保持盐酸过量,其目的是 。
(6)由过滤2得到的滤液制备BaCl2的实验操作依次为 、冷却结晶、 、洗涤、干燥。
化合物A只由两种非金属元素组成,A不稳定,一定条件下爆炸生成B、C,以下为相关物质的转化关系,其中B、C、D、J为单质,其中B、D为空气的主要成分,只有J为固体,E为红棕色氧化物固体,反应①、②都是工业生产上的重要反应(部分生成物略),④反应中K过量。

(1)写出反应②的化学反应方程式 。
(2)G的水溶液呈碱性的原因是 。
(3)标况下,将集满H气体的试管倒扣于水槽中,充分反应后所得溶液的物质的量浓度为 。
(4)P→Q反应过程中会观察到的实验现象为 。
(5)如何检验M溶液中阳离子 。
(6)M溶液在强碱性环境下可被KClO溶液氧化制得K2JO4试着写出该反应的离子方程式: 。
在人类社会的发展进程中,金属起着重要的作用。
(1)以下有关金属单质的叙述正确的是。
A.金属钠非常活泼,在实验室中保存在石蜡油或煤油中
B.用坩埚钳夹住一小块铝箔,在酒精灯上加热,可观察到铝箔熔化,并有熔融物滴下
C.铁单质与水蒸气反应的化学方程式为:2Fe+3H2O(g) Fe2O3+3H2
Fe2O3+3H2
(2)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。

①A点的沉淀物的化学式为 。
②写出A点至B点发生反应的离子方程式: 。
③某溶液中溶有MgCl2和AlCl3两种溶质,若把两者分开,应选用的试剂为: 。
④原混合物中NaOH的质量是 g,C点(此时沉淀恰好完全溶解)HCl溶液的
体积为 mL。