有一包白色固体粉末,由CaCO3、Na2SO4、KCl、Ba(NO3)2、CuSO4中的几种物质组成,取样品进行如下实验(假设下列过程中,能反应的物质之间的反应恰好完全):

(1)步骤“①”所用分离方法叫做 ,要从步骤②所得“无色溶液”中提取溶剂,所用分离方法叫做 。
(2)写出实验过程中发生化学反应的离子方程式 。
(3)固体粉末中一定不存在的物质是(填化学式,下同) ;一定存在的物质是 。
(4)将固体粉末可能的组成填入下表(可以不填满,也可以再补充)
| 序号 |
化 学 式 |
| Ⅰ |
|
| Ⅱ |
|
| Ⅲ |
|
(5)设计一个实验,进一步确定混合物的组成,简述实验操作、现象和结论。
写出下列反应的离子方程式(每小题1分,共4分)
(1)铝与氢氧化钾浓溶液反应
(2)向偏铝酸钠溶液中通过量二氧化碳
(3)向NaHSO 4 溶液中加入Ba(OH)2 使溶液呈中性
(4)过氧化钠与稀食盐水反应
(6分)写出下列反应的离子方程式:
(1)用稀硫酸清洗铁锈(Fe2O3)
(2)碳酸钠溶液与盐酸混合
(3)向足量澄清石灰水中通入二氧化碳
火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol•L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。
③ 某研究小组为探究提高含硫烟气中SO2的
吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则: ,
有利于提高SO2的吸收效率。
(3)工厂仓库存放的Na2SO3药品已部分被空气
氧化,该化学小组想用已知浓度的酸性KMnO4
溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式___________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是_ (填字母)。



A B C D E
④ 滴定结果如下表所示:
| 滴定次数 |
待测溶液 的体积/mL |
标准溶液的体积 |
|
| 滴定前刻度/mL |
滴定后刻度/mL |
||
| 1 |
25.00 |
1.02 |
21.03 |
| 2 |
25.00 |
2.00 |
21.99 |
| 3 |
25.00 |
2.20 |
20.20 |
则该药品中Na2SO3的质量分数为_________。
雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)氮、氧元素非金属性较强的是 。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示: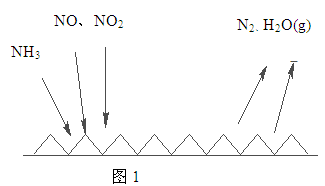

①由图1可知SCR技术中的氧化剂为 。
②用Fe做催化剂时,在氨气足量的情况下,不同c(NO2)/c(NO)对应的脱氮率如图2所示,脱氮效果最佳的c(NO2)/c(NO)= 。当NO2与NO的物质的量之比为1:1时,用氨脱氮,每生成1molN2放出的热量为QkJ,写出该反应的热化学方程式 。
(3)海水具有良好的吸收SO2的能力,其吸收过程如下:
①SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32-,SO32-可以被海水中的溶解氧氧化为SO42-。海水的pH会 (填“升高” 、“不变”或“降低”)。
②SO2和O2在H2SO4溶液中可以构成原电池,其负极反应式是 。
(4)碲(Te)为ⅥA族元素,是当今高新技术新材料的主要成分之一。工业上可将SO2通入TeCl4的酸性溶液中进行“还原”得到碲,该反应的化学方程式是_________ 。
在下列各变化中,E为常温下无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。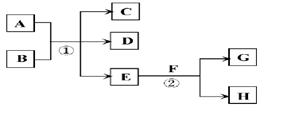
回答下列问题:
(1)写出H的电子式:
(2)若反应①在加热条件下进行,A为单质,C为无色有刺激性气味的气体,D为无色无味的气体,且C、D两种气体均能使澄清的石灰水变浑浊,则反应①的化学方程式是 。
①实验需要检验出C、D、E三种气体产物,三种气体检验的先后顺序是 (用化学式填空),在检验D气体前,需除去C气体,所用试剂是 ,反应的离子方程式是 。
②已知:A(s)+O2(g) =AO2(g) △H=-393.5kJ·mol-1
2A(s)+O2(g) =2AO(g) △H=-221.0kJ·mol-1
则AO的燃烧热的热化学方程式___________________.
③AO2在自然界循环时可与碳酸钙反应,碳酸钙是一种难溶物质,它的Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为 。
(3)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,且B遇盐酸产生能使品红溶液褪色的气体,在加热条件下,当A过量时,反应①的离子方程式是 。
(4)若反应①在溶液中进行,A是一种强酸,B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素组成,当A过量时,C及D均易溶于水,则A过量时反应①的离子方程式是 。
(14分,每空2分)
某中学的化学兴趣小组对SO2与漂白粉的反应进行实验探究,实验过程如下:取10克漂白粉固体,加入250mL水中,部分固体溶解溶液略有颜色,过滤后用洁净的玻璃棒沾取滤液到pH试纸上,发现pH试纸先变蓝(约为12)后褪色.回答下列问题:
(1)工业制取漂白粉的化学方程式是 __ ,
漂白粉在空气中变质的原因 (用化学反应方程式说明)
(2)pH试纸颜色的变化说明漂白粉溶液具有的性质是 ,ClO2和漂白粉一样也具有强氧化性,其消毒效率(以单位物质的量得电子的数目表示)是Cl2的 倍;
(3)将SO2持续通入漂白粉溶液中,发现澄清透明的溶液先变为黄绿色,随后溶液中产生大量白色沉淀且黄绿色褪去。回答下列问题:
①澄清透明溶液变为黄绿色的可能原因是:随溶液酸性的增强,漂白粉的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是 ;
②用离子方程式解释现象中黄绿色褪去的原因: ;
③SO2与漂白粉的有效成分在酸性条件下反应的离子方程式: 。
已知:A为含金属离子的淡黄色固体化台物,E、X为空气中常见气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。
请回答下列问题
(1)这种金属离子的离子结构示意图为_____________;
(2)X的电子式_______________;
(3)B中所含化学键的类型是_____________;
常温常压下,7.8gA与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式
_________________________________________________________________.
(4)①C也可转化为B,写出该转化的化学方程式_______________________________;
②B与D反应的离子方程式为_______________________________________.
(5)将一定量的气体X通入2LB的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量, 产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。
请回答:a点溶液中所含溶质的化学式为__________ ,b点溶液中各离子浓度由大到小的关系是_________________________________。
已知用NaAlO2制备α—Al(OH)3及能量转化关系如图:
(1)反应②的热化学方程式为 。
(2)根据上述能量转化关系,拜耳公司找到了一种简捷的从铝土矿获取Al2O3的方法,流程如下:
①物质A的化学式为 ;
②步骤Ⅲ的化学反应方程式为 ;检验步骤Ⅲ中沉淀是否洗净的方法是 ;
③步骤Ⅱ采用冷却的方法析出α—Al(OH)3,该措施的依据是 ;
④工业上可电解上述产物Al2O3以获得Al,若获得2.7kgAl,则理论上消耗A的物质的量至少为 mol。有人提出用熔融Na[AlCl4]与NaCl的混合物代替Al2O3进行电解获得Al,则阴极反应为 。