氧化剂和还原剂在生产生活中广泛使用。
(1)高锰酸钾和氢溴酸溶液可以发生如下反应:
2KMnO4+ 16HBr = 5Br2+ 2MnBr2+ 2KBr+ 8H2O
①其中还原剂为 ,还原产物为
②若有0.8 mol还原剂被氧化,则转移电子的物质的量是
(2)双氧水H2O2可作为矿业废液消毒剂,可以消除采矿业废液中的氰化物(如KCN,其中N为﹣3价),化学方程式为:KCN+H2O2+H2O═KHCO3+A↑(已配平)
①生成物A的化学式为
②用双线桥法表示该反应中电子转移的方向和数目:
(3)古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:
NaClO+ NH3·H2O 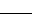 N2H4 + NaCl+ H2O
N2H4 + NaCl+ H2O
①请配平上述化学方程式
②NH3·H2O在上述反应中显示出来的性质是
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
(4)人体内所含铁元素以Fe2+和Fe3+的形式存在市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为 ,但Fe2+在酸性条件下很容易被空气中的氧气氧化,写出该反应的离子方程式
 2NH3(g ) △H<0,反应中NH3的物质的量浓度变化情况如右图:
2NH3(g ) △H<0,反应中NH3的物质的量浓度变化情况如右图: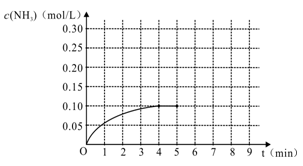
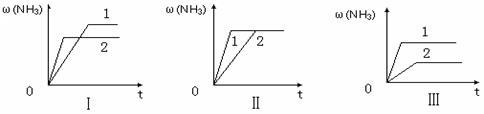





 2 SO3(g)△H="-196.6" kJ·mol-l
2 SO3(g)△H="-196.6" kJ·mol-l

 粤公网安备 44130202000953号
粤公网安备 44130202000953号