硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1。
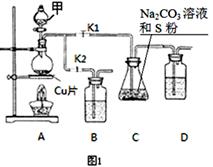
已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)步骤1:打开K1、关闭K2,向圆底烧瓶中加入足量甲并加热,写出反应的方程式: 。
(2)步骤2:始终保持C中溶液呈碱性,反应一段时间后,硫粉的量逐渐减少,打开K2、关闭K1并停止加热。
①C中溶液须保持呈碱性的原因:若呈酸性,则 、 。(用离子方程式表示)
②装置B、D的试剂相同,均为 。
步骤3:将C中所得混合物分离提纯后得产品。
(3)利用反应2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2也能制备Na2S2O3。所需仪器如图2,按气流方向连接各仪器,接口顺序为:a→____,____→ , → , →d。
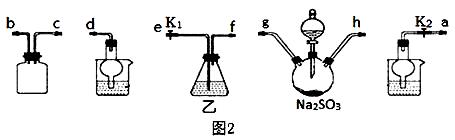
(4)装置乙盛装的试剂是:_____________________________。
(5)Na2S2O3还原性较强,工业上常用作除去溶液中残留的Cl2,该反应的离子方程式为 。
(6)请设计简单的实验方案,证明上述残留的Cl2被还原成了Cl—:____________
一瓶溶液里可能含有K+,OH-,Cl-,NO3-,CO32-,SO42-等离子中的某几种,现分别取两等份该溶液分装于两支试管里,做以下实验:
(1)向第一支试管里滴入酚酞试液,溶液变红色。
(2)第二支试管里加入足量Ba(NO3)2溶液,产生白色沉淀19.7克,过滤后并将滤液移入第三支试管,向沉淀中加入稀硝酸,沉淀逐渐消失,并有无色气体产生,该气体通入澄清石灰水,立即产生混浊。
(3)向第三支试管中加入足量的稀硝酸,再滴加少量AgNO3溶液,无现象。
(4)经测定,第一支试管溶液中含K+0.3mol,OH-0.05mol。
根据实验,判断溶液中肯定含有的阴离子有(用离子符号表示)__________,一定不含的离子有(用离子符号表示)__________。写出⑵中加入Ba(NO3)2溶液,产生的白色沉定的化学式: ,该沉淀溶于硝酸溶液的离子方程式: 。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(以下数据和实验均指在25℃下测定)
| 难溶电解质 |
CaCO3 |
CaSO4 |
| Ksp |
2.8×10-9 |
9×10-6 |
实验步骤如下:
①往100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入足量Na2CO3 固体,搅拌,静置,沉淀后弃去上层清液.
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液.
④________________________。
(1)步骤①所得悬浊液中c(Ca2+)=________ mol·L-1
(2)写出第②步发生反应的离子方程式:_______________________
(3)请补充第④步操作及发生的现象___________________________
(4)请写出该原理在实际生产生活中的一个应用________________________
(1)写离子方程式a.氯化铝溶液中加入过量氨水的离子方程式为_______________;b.碳酸钙与盐酸反应的离子方程式为______________
(2)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,发生反应的离子方程式为_______________;在上述溶液中,继续滴加Ba(OH)2溶液,此步反应的离子方程式为_______________________。
(3)一个完整的氧化还原反应方程式可以拆开写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。
如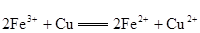 的拆写
的拆写
结果是:氧化反应为: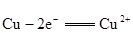 ;
;
还原反应为: 。
。
①请据此将反应: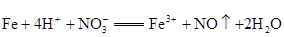
拆写成两个“半反应式”:氧化反应为__________________;还原反应为__________________。
铈、钛、锌、锰虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,反应中CeO2作 剂。在加热条件下,CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是______________ 。
(2)钛(Ti)被誉为“二十一世纪的金属”。
①在高温下,向金红石(主要成分Ti02)与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体。该反应的化学方程式是 。
②加热条件下,镁与TiCl4反应可得到钛,下列气体可以作为保护气的是
A.O2 B.N2 C.C02 D.Ar
(3)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。写出锌和氢氧化钠溶液反应的化学方程式 。
(4)锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料。
①已知A~G各物质间的关系如下图,其中B、D为气态单质。

则反应②的离子方程式为_______________________________________。
②制备Mn02的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为 。已知:Ksp[Al(OH)3]=1×10-33,pH=7.1时Mn(OH)2开始沉淀。室温下,欲除去MnSO4溶液中的Al3+(使其浓度小于1×10-6mol·L-1),需调节溶液pH范围为________。
在Cl-浓度为0.5 mol·L-1的某无色澄清溶液中,还可能含有下表中的若干种离子。
| 阳离子 |
K+Al3+Mg2+Ba2+ Fe3+ |
| 阴离子 |
NO3-CO32-SiO32-SO42- OH- |
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
| 序号 |
实验内容 |
实验结果 |
| Ⅰ |
向该溶液中加入足量稀盐酸 |
产生白色沉淀并放出标准状况下0.56 L气体 |
| Ⅱ |
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 |
固体质量为2.4 g |
| Ⅲ |
向Ⅱ的滤液中滴加BaCl2溶液 |
无明显现象 |
请回答下列问题。
(1)通过以上实验能确定一定不存在的离子是____ ____。
(2)实验Ⅰ中生成沉淀的离子方程式为___________________________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满)。
| |
阴离子 |
浓度c/(mol·L-1) |
| ① |
|
|
| ② |
|
|
| ③ |
|
|
| ④ |
|
|
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由:_____________。
为建设美丽浙江,浙江省政府开展“五水共治”。
(1)城市饮用水处理时可用二氧化氯(ClO2)替代传统的净水剂Cl2。工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:_______________。
(2)某地污水中的有机污染物主要成分是三氯乙烯 (C2HCl3),向此污水中加入KMnO4(高锰酸钾的还原产物为MnO2)溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出该反应的化学方程式_________________。
按下列要求填空:
(1)写出过氧化氢和过氧化钠的电子式: 、 。
(2)已知叠氮酸(HN3)是与醋酸酸性相近的酸。写出其在水溶液中电离的方程式: 。
(3)已知水溶液中,YO3n-和3S2-发生反应,离子方程式如下:YO3n-+3S2-+6H+=Y-+3S↓+3H2O,则微粒YO3n-所带的电荷为 。
(4)写出钢铁吸氧腐蚀中正极的电极反应式: 。
(5)在标准状况下,1L水中能溶解a L氯化氢气体,所得溶液密度为ρg/cm3 。请计算出氢化氢的物 质的量浓度(要求化简) 。
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Fe、Cr等杂质)为原料获得。工艺流程如下图:
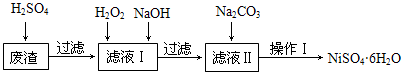
已知:25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表所示。
| |
Fe(OH)2 |
Fe(OH)3 |
Cr(OH)3 |
Ni(OH)2 |
| Ksp |
8.0×10—16 |
4.0×10—38 |
6.0×10—31 |
6.5×10—18 |
| 完全沉淀pH |
≥9.6 |
≥3.2 |
≥5.6 |
≥8.4 |
注:NiCO3是一种不溶于水易溶于强酸的沉淀。
请回答下列问题:
(1)下列措施可行,且能提高废渣浸出率的有 。
A.升高反应温度 B.增大压强 C.在反应过程中不断搅拌
(2)在滤液Ⅰ中加入6%的H2O2,其作用是 (用离子方程式表示);
加入NaOH调节pH的范围是 ,为了除去溶液中的 离子。
(3)滤液Ⅱ的主要成分是 。
(4)检验Ni2+已完全沉淀的实验方法是 。
(5)操作Ⅰ的实验步骤依次为:
① ;
② ;
③蒸发浓缩、冷却结晶,过滤得NiSO4•6H2O晶体;
④用少量乙醇洗涤NiSO4•6H2O晶体并晾干。
聚硅硫酸铁(PFSS)是新型无机高分子混凝剂,广泛应用于水的净化处理。PFSS化学组成可表示为:[Fe2(OH)n(SO4)3-n/2(SiO2)x]m,由钢渣合成PFSS主要工艺流程如下:

(1)酸浸时,采用100~140℃和2~3h,其目的是 。
(2)氧化时,需将溶液冷却到40℃以下,其目的是 。
(3)除Al3+时,先调节pH值到 。(参见表),得Fe(OH)3沉淀,过滤除去滤液,再用硫酸溶解Fe(OH)3得硫酸铁溶液。
| |
开始沉淀 pH |
沉淀完全 pH |
| Al3+ |
3.5 |
4.7 |
| Fe3+ |
1.9 |
3.2 |
(4)Na2SiO3溶液可由SiO2渣除杂后与35%的NaOH溶液反应制备,该反应的离子方程式为 。
(5)水解聚合时,强力搅拌的目的是 ;检验透明橙红色液体中,其分散质直径在l~l00nm的简单方法是 。
(1)写出下列化学反应的离子方程式
①氢氧化钡溶液和硫酸溶液反应__________________________________
②碳酸钙和足量稀盐酸反应___________________________________
(2)根据下列离子方程式,各写一个符合条件的化学方程式
①Zn+2H+==Zn2++H2↑_______________________________
②HCO3-+ H+==CO2↑+ H2O____________________________________
按要求作答:
(1)写出氢氧化铜和盐酸反应的离子方程式 ;
(2)写出实验室制CO2反应的离子方程式 ;
(3)写出Na与H2O反应的离子方程式 ;
(4)除去Na2SO4溶液中的Na2CO3杂质,选用的试剂是 ,写出对应反应的离子方程式 。
按要求书写下列反应的离子方程式:
(1)往澄清石灰水中通入少量二氧化碳,请写出此反应的离子方程式: 。
(2)锌粒投入稀H2SO4中,溶液里氢离子的量减少,锌离子的量增加, 离子的量没有变化,反应的离子方程式是 。
(3)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式: 。
(4)将过量的二氧化碳气体通入烧碱溶液中,然后将反应后的溶液分成二等份,分别加入与所得溶液溶质,等物质的量的硝酸、氢氧化钙溶液。请分别写出发生反应的离子方程式:
① 。
② 。
有以下物质:①石墨;②铝;③酒精;④氨水;⑤二氧化碳;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧纯醋酸;⑨氧化钠固体;⑩氯化氢气体。
(1)其中能导电的是 ;属于非电解质的是 ;属于强电解质的是 ;属于弱电解质的是 。
(2)写出物质⑥溶于水的电离方程式: 。
(3)写出物质⑥和⑧在水中反应的离子方程式: 。
(4)将物质⑥配制成溶液,逐滴加入⑦溶液中至沉淀量最大,写出离子方程式: ,检验离子沉淀完全的方法是 ,洗涤沉淀的方法是 。