短周期元素X、Y、Z、W、Q在元素周期表中的位置如下表所示,其中Q元素的原子的K、M层的电子数之和等于L层的电子数,则下列说法正确的是
| A.X的氧化物是红宝石、蓝宝石的主要成分 |
| B.Q的最高价氧化物的水化物的浓溶液中只存在一种分子 |
| C.W的氧化物有多种,其中+2价的氧化物有毒,对人体只有危害 |
| D.Z的单质可由Z的氧化物与Y的单质反应制得,说明单质Y还原性强于单质Z |
钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下: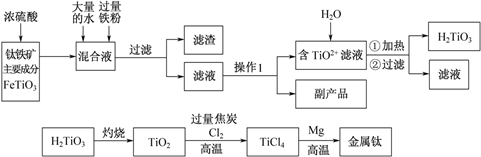
请回答下列问题:
(1)铁在元素周期表中的位置为 。
(2)写出TiO2+水解的离子方程式: 。
加入过量铁粉的作用是:① ;② 。
(3)操作 Ⅰ的实验步骤为:___________________,过滤。
(4)副产品主要成分的化学式为 。
(5)写出TiO2转化成TiCl4的化学方程式: 。
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是
| A.ZY、ZW、W2X的水溶液都显酸性 |
| B.原子半径大小:W>R>X,简单离子半径大小:R>W>X |
| C.W的氢化物与R的氢化物水溶液的酸性比较,前者强于后者,可证明非金属性:R>W |
| D.Z与X、Z与R两种元素形成的化合物中均可能存在共价键 |
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,X与Z可形成常见的XZ或XZ2型分子,Y与M形成的气态化合物质量是相同条件下同体积氢气的8.5倍,W是原子半径最大的短周期元素。下列判断正确的是
| A.最高价含氧酸酸性:X<Y | B.X、Y、Z可形成离子化合物 |
| C.W可形成双原子分子 | D.M与W形成的化合物含极性共价键 |
甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是
| A.丙与庚的原子序数相差3 |
| B.气态氢化物的热稳定性:戊>己>庚 |
| C.乙所在周期元素中,其简单离子的半径最大 |
| D.乙的单质在空气中燃烧生成的化合物只含离子键 |
某汽车安全气囊的产气药剂主要含有、
、
、
等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)是气体发生剂,受热分解产生
和
,
的电子式为。
(2)是主氧化剂,与
反应生成的还原产物为(已知该反应为置换反应).
(3)是助氧化剂,反应过程中与
作用生成
和
。
含有化学键的类型为,
的原子结构示意图为。
(4)是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为。
(5)100上述产气药剂产生的气体通过碱石灰后得到
33.6
(标准状况)。
①用碱石灰除去的物质为;
②该产气药剂中的质量分数为。
下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是
| A.X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增 |
| B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 |
| C.YX2晶体熔化、液态WX3气化均需克服分子间作用力 |
| D.根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性 |
白云石的主要成份是,在我国有大量的分布。以白云石为原料生产的钙镁系列产品有广泛的用途。白云石经煅烧、熔化后得到钙镁的氢氧化物,再经过碳化实现
、
的分离。碳化反应是放热反应,化学方程式如下:
完成下列填空
23.的碱性比
的碱性(选填"强"或"弱")
的溶解度比
的溶解度(选填"大"或"小")
24.碳化温度保持在50~60℃。温度偏高不利于碳化反应,原因是、。温度偏低也不利于碳化反应,原因是。
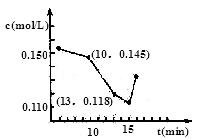
25.已知某次碳化时溶液中钙离子浓度随时间的变化如图所示,在10 到13
之内钙离子的反 应速率为。15
之后钙离子浓度增大,原因是(用化学方程式表示)。
26.原子核外电子排布式为;
原子最外层电子的能量
原子最外层电子的能量(选填"低于"、"高于"或"等于")。
是常见的六种元素。
(1)
位于元素周期表第周期第族。
(2)
的基态原子核外电子排布式为;
的基态原子最外层有个电子。
(3)用">"或"<"填空:
| 原子半径 |
电负性 |
熔点 |
沸点 |
| 金刚石晶体硅 |
|
(4)常温下,将除去表面氧化膜的
、
片插入浓
中组成原电池(图1),测得原电池的电流强度(
)随时间(
)的变化如图2所示,反应过程中有红棕色气体产生。
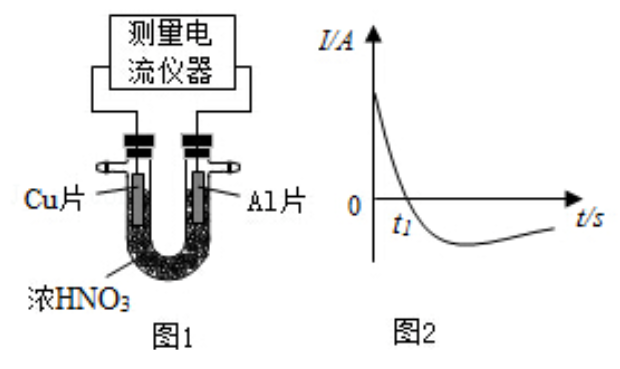
0- 时,原电池的负极是 片,此时,正极的电极反应式是,溶液中的 向极移动, 时,原电池中电子流动方向发生改变,其原因是。
(本题共12分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
23、第三周期元素的原子所形成的简单离子中:还原性最弱的阴离子是 ;氧化性最强的阳离子是 。
24、下列事实可以作为S和Cl非金属性强弱的判断依据的是 (选填序号)
a.Cl的最高正价比S高 b.可用浓H2SO4制HCl
c.HCl的酸性比H2S强 d.Cl2与H2S反应生成S
25、硅元素最外层有 种能量不同的电子;SiCl4的空间构型和CH4相同,写出SiCl4的电子式: 。
26、PH3和NH3的某些化学性质相似。下列对晶体PH4I性质的推测,错误的是 (选填序号)
a.PH4I是一种共价化合物 b.PH4I能与烧碱溶液反应
c.PH4I加热后会发生升华 d.PH4I溶液能与溴水反应
27、二氯化二硫(S2C12)可用作橡胶工业的硫化剂,它的分子结构与H2O2相似。下列有关说法不正确的是 (选填序号)
a.S 2C12分子中有4对共用电子对
b.S2C12分子中没有非极性键
c.S2C12分子中,S为+1价,Cl为-1价
d.S2C12分子中各原子均为8电子稳定结构
28、已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3-+H2O H2SO3+OH- ①
H2SO3+OH- ①
HSO3- H++SO32- ②
H++SO32- ②
向0.1mol/L的NaHSO3溶液中加入少量氢氧化钠固体,则 (填“增
(填“增
大”“减小”或“不变”,后同), 。
。
X、Y、Z、W是原子序数依次增大的四种短周期元素,X的最高价氧化物对应的水化物的化学式为H2XO3,Y的最外层电子数是电子层数的3倍,Z是地壳中含量最高的金属元素,W的一种核素的质量数为28,中子数为14。下列说法正确的是
| A.原子半径由大到小的顺序是Z>W>Y>X |
| B.元素的非金属性W>Y>X |
| C.Z2Y3、WX分别是离子化合物、共价化合物 |
| D.X、Z、W的最高价氧化物都是酸性氧化物 |
A、B、C、D是原子序数依次增大但互不同主族的短周期元素,A2¯与B3+有相同电子层结构,C、D同周期但不相邻,C的最外层电子数是次外层电子数的一半,下列判断正确的是:
A.对应简单离子半径的大小顺序为:D>B>A
B.C的最高价氧化物对应水化物的酸性比D的强
C.A分别与B、C形成的化合物中化学键类型相同
D.B、C单质均能和氢氧化钠溶液发生反应生成氢气
X、Y、M、N是短周期主族元素,且原子序数依次增大。已知X原子的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大。下列说法正确的是
| A.M与X的化合物对应的水化物一定是强酸 |
| B.Y2X和Y2X2中化学键类型相同,阴、阳离子的个数比相同 |
| C.气态氢化物的热稳定性:M > N |
| D.离子半径r:r(X2-)> r(Y+) |
下表为元素周期表的一部分, 请参照元素①~⑧在表中的位置, 用化学用语回答下列问题:
(1)画出元素⑦的原子结构示意图_________________________。
(2)②、 ③、 ⑦的最高价含氧酸的酸性由强到弱的顺序是____________ (填化学式)
(3)①、 ④、 ⑤、 ⑨中的某些 ··元素可形成既含离子键又含共价键的化合物, 写出其中一种化合物的化学式: ___________。
(4)写出元素③的气态氢化物与其最高价含氧酸的离子方程式___________________写出元素②的单质与元素⑧最高价含氧酸浓溶液的反应化学反应方程式_______________
(5)由表中元素形成的常见物质X、 Y、 Z、 M、 N可发生以下反应:
X溶液与Y溶液反应的离子方程式为_____________________________。
(14分)下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:
(1)非金属性最强的是 (填元素符号)、化学性质最不活泼的是______(填元素符号)。
(2)由①、④、⑥、⑨中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(3)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是_____________(填化学式)。
(4)表中能形成两性氢氧化物的元素是 (填元素符号),分别写出该元素的氢氧化物与⑥、⑧最高价氧化物的水化物反应的离子方程式: , 。
(5)请设计一个实验方案,比较④、⑧单质氧化性的强弱,并描述现象和结论: __