下列说法不正确的是
| A.某金属元素气态基态原子的逐级电离能的数值分别为738、1451、7733、10540、13630、17995、21703…,当它与氯气反应时生成的阳离子是X3+ |
B. 均能一步实现 均能一步实现 |
| C.33gCH≡C-CH=CH-CH3中所含的π键数、12g石墨中所含的碳碳键数均为1.5mol |
| D.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,可能含有K+ |
氨和水都是常用的试剂。请回答下列问题:
(1)氮元素在元素周期表中的位置是 ;基态氮原子的核外电子中,未成对电子数与成对电子数之比为____________。
(2)NH3分子可结合一个H+形成铵根离子(NH)。
①NH3分子中N原子的杂化类型是____________。
②NH3分子与H+结合的过程中未发生改变的是____________(填选项字母)。
A.微粒的空间结构 B.N原子的杂化类型 C.H—N—H的键角
(3)将氨气通入CuSO4溶液中,产生蓝色沉淀,继续通过量氨气,沉淀溶解,得到蓝色透明溶液。[Cu(H2O)6]2+(水合铜离子)和[Cu(NH3)4]2+中共同含有的化学键类型是 。生成蓝色沉淀的离子方程式是 。
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。根据判断出的元素回答下列问题: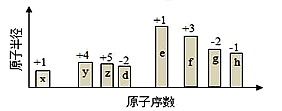
(1)f 在元素周期表的位置是__________。
(2)比较y、g、h最高价氧化物对应水化物的酸性强弱是:_______>________>_______。(用化学式表示)
(3)由表中两种元素的原子按1:1组成的化合物A和B,A中既含离子键又含非极性共价键,其电子式为__________;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为____________。(填序号)
| A.MnO2 | B.FeCl3 | C.Na2SO3 | D.KMnO4 |
 (4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应: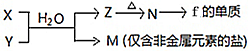
①
 X溶液与Y溶液反应的离子方程式为__________________________
X溶液与Y溶液反应的离子方程式为__________________________
②常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至________________
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10 mL 1mol·L-1 R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀的物质的量随NaOH溶液体积变化如图所示: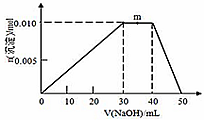
①写出m点反应的离子方程式____________。
②若R溶液中改加20mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为____________mol。
X、Y、Z、R、W是原子序数依次增大的短周期主族元素,X是元素周期表中原子半径最小的元素。X与Z同主族,Y与W同主族,R最外层电子数是电子层数的2倍。下列叙述正确的是
| A.原子半径:W>R>Z |
| B.W的最高价氧化物对应的水化物酸性比R的强 |
| C.W与X形成的是离子化合物 |
| D.W的气态氢化物的热稳定性比Y的强 |
掺杂微量铜、硼、镓、硒等元素的单晶硅太阳能电池是第三代太阳能电池之一。
(1)Cu2+的电子排布式为___________________。
(2)已知铜转化为水合离子过程如下:
已知I1=745.5kJ/mol,I2=1957.3kJ/mol。在水溶液中Cu2+比Cu更稳定的原因是_____________。
(3)铜与类卤素(SCN)2反应生成Cu(SCN)2。1mol(SCN)2含有π键的数目为_______________。HSCN有两种结构,H-S-C≡N(硫氰酸)的沸点低于H-N=C=S(异硫氰酸)的沸点,其原因是_________________。
(4)BF3能与NH3反应生成配合物BF3-NH3,该配合物中B原子的杂化方式为___________________。
(5)铜和硒可形成的半导体团簇分子的球棍模型如图所示,其分子式为__________________。
(6)镓与某有机物形成的配合物过程如下图,在图上画出产物中的配位键。
(7)与Si同周期部分元素的电离能如下图所示,其中a、b和c分别代表_____________。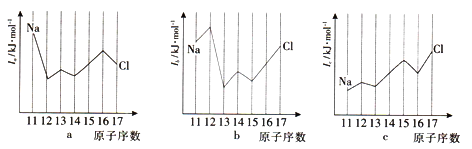
| A.a为I1、b为I2、c为I3 | B.a为I2、b为I3、c为I1 |
| C.a为I3、b为I2、c为I1 | D.a为I1、b为I3、c为I2 |
A、B、C、D、E为原子序数依次增大的短周期元素,B、C相邻且同周期,C原子中含有8种运动状态不同的电子。A、C能形成两种化合物甲和乙,原子个数比分别为2∶1和1∶1,甲为常见的溶剂。D是地壳中含量最多的金属元素。E元素为同周期电负性最大的元素。D和E可形成化合物丙。F为第四周期未成对电子数最多的元素。请回答下列问题:
(1)写出F基态原子的外围电子排布式 。
(2)B和C比较,第一电离能较大的元素是 (填元素符号)。
(3)甲、乙两分子中含有非极性共价键的是 (填分子式)。
(4)已知化合物丙熔点190℃,沸点183℃,结构如右图所示。

①丙属于 晶体。
②丙含有的作用力有 (填序号)。
A 离子键 B 共价键 C 金属键
D 配位键 E 范德华力
(5)F3+与元素A、C、E构成配合物戊,在含有0. 1mol戊的溶液中加入过量AgNO3溶液,经过滤、洗涤、干燥后,得到28.7g白色沉淀。已知该配合物的配位数为6,则戊的化学式为 。
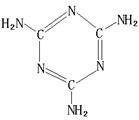
(6)三聚氰胺(结构如右图)由于其含氮量高被不法奶农添加到牛奶中来“提高”蛋白质的含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。三聚氰胺中N原子的杂化类型是 。
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
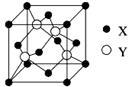
(1)X与Y所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,X离子的数目为 。
②该化合物的化学式为 。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 。
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是 。
(4)Y 与Z 可形成YZ42-
①YZ42-的空间构型为 。
②写出一种与YZ42-互为等电子体的分子的化学式: 。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的离子不含电子;B元素的最高价氧化物对应水化物与其氢化物能反应生成盐F;D与A同主族,且与 E同周期;E元素原子的最外层电子数是其次外层电子数的 3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题:
(1)E元素在元素周期表中的位置是_______________。
(2)由A、B、C三种元素形成的离子化合物的化学式为_________________。
(3)A可分别与C、E形成甲、乙两种三原子分子,且甲有18个电子、乙有10个电子,甲与乙比较,沸点较高的是(填化学式)_______________。
(4)F含有的化学键类型是___________和_____________,其水溶液呈酸性,请用相关的离子方程式解释其原因___________。
(5)D和C形成的一种化合物能与A和C形成的一种化合物反应产生C单质,该过程的化学方程式为______。
已知T、X、Y、Z是中学化学常见的四种元素,其结构或性质信息如下表:
| 元素 |
结构或性质信息 |
| T |
原子的L层上s电子数等于p电子数. |
| X |
元素的原子半径是第三周期主族元素中最大的. |
| Y |
空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z |
单质常温、常压下是气体.原子的M层上有1个未成对的p电子. |
请根据信息回答有关问题:
(1)写出与Y2互为等电子体的分子式______________;
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是______________;
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是______________;
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的最外层电子排布式为______________;
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是_________、___________;
③元素Q形成的单质的晶体结构如下图所示,该晶体形成时的原子堆积方式是__________(选填“甲”、“乙”、“丙”)。
下图是元素周期表的一部分
(1)元素⑩的次外层电子数为__________个。
(2)如果在温度接近373K时,根据M=m/n测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是___________________;
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式____________________;
(4)根据下列五种元素的第一至第四电离能数据(单位:kJ•mol-1),回答下面各题:
| 元素代号 |
I1 |
I2 |
I3 |
I4 |
| Q |
2080 |
4000 |
6100 |
9400 |
| R |
500 |
4600 |
6900 |
9500 |
| S |
740 |
1500 |
7700 |
10500 |
| T |
580 |
1800 |
2700 |
11600 |
| U |
420 |
3100 |
4400 |
5900 |
①在周期表中,最可能处于同一主族的是_________.(填元素代号)
②T元素最可能是________(填“s”、“p”、“d”、“ds”等)区元素;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为____________。
二氧化氯(ClO2)是国际公认高效、安全的杀菌、保鲜剂,是氯制剂的理想替代品。工业上制备ClO2的方法很多,NaClO3和NaClO2是制取ClO2的常见原料。
完成下列填空:
(1)以下反应是制备ClO2的一种方法:H2C2O4 + 2 NaClO3 + H2SO4 → Na2SO4 + 2 CO2↑ + 2 ClO2↑ + 2 H2O,上述反应物中属于第三周期的元素的原子半径大小顺序是__________;其中原子半径最大元素的原子,其核外有 种不同能量的电子。
(2)ClO2的分子构型为“V”形,则ClO2是______________(选填“极性”、“非极性”)分子,其在水中的溶解度比氯气__________(选填“大”、“小”、“一样”)。
(3)ClO2具有强氧化性,若ClO2和Cl2在消毒时自身均被还原为Cl-,ClO2的消毒能力是等质量Cl2的___________倍(保留2位小数)。
(4)若以NaClO2为原料制取ClO2,需要加入具有________(填“氧化”、“还原”)性的物质。
(5)工业上将氯碱工业和制取NaClO3联合进行。研究发现,电解时,不同反应环境下的总反应分别为:
4 NaCl + 18 H2O → 4 NaClO3 + 3 O2↑+ 18 H2↑(中性环境)
NaCl + 3 H2O → NaClO3 + 3 H2↑(微酸性环境)
①电解时,氢气在__________极产生。
②更有利于工业生产NaClO3的反应环境是___________,理由__________________。
X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的基态原子L层电子数是K层电子数的2倍 |
| Y |
Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z |
Z存在质量数为23,中子数为12的核素 |
| W |
W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W位于元素周期表第 周期第 族,其基态原子最外层有 个电子。
(2)X的电负性比Y的 (填“大”或“小”);X 和Y的气态氢化物中,较稳定的是 (写化学式)。
(3)写出Z2Y2与XY2反应的化学方程式,并标出电子转移的方向和数目:
(4)在X的原子和氢原子形成的多分子中,有些分子的核磁共振氢谱显示两种氢,写出其中一种分子的名称: 。氢元素,X、Y的原子也可共同形成多种分子和几种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式: 。
有A、B、C、D、E 五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)以上这五种元素中,属于S区的是____________________(填元素符号)。
(2)C、D、E四种元素的简单离子按半径由小到大的顺序为(用离子符号表示)____________。
(3)写出D元素基态原子的外围电子排布式__________________________________。
(4)元素电负性为B___________D,元素第一电离能为C__________E。(填“﹥”、“﹤”或“﹦”)
(5)由这五种元素组成的一种化合物是____________________(写化学式)。[来
H、C、N、O、Al、S是常见的六种元素。
完成下列填空:
(1).碳元素有12C、13C和14C等同位素。在14C原子中,核外存在 对自旋相反的电子。
(2).碳在形成化合物时,其所成化学键以共价键为主,原因是 。
(3).任选上述元素可组成多种四原子的共价化合物,请写出其中含非极性键的一种化合物的电子式 。
(4).上述元素可组成盐NH4Al(SO4)2。向10mL1mol/L NH4Al(SO4)2溶液中滴加1mol/L的NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下。

①NH4Al(SO4)2溶液中所有离子的浓度由大到小的顺序是 ,请解释阳离子浓度差异的原因 。
②写出N点反应的离子方程式 。
③若向10mL1mol/L NH4Al(SO4)2溶液中加入20mL1.2mol/LBa(OH)2溶液,充分反应后,产生沉淀______ mol。