钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下: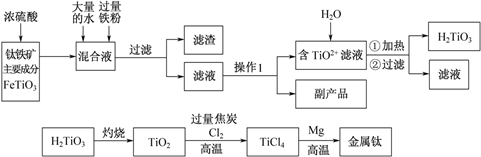
请回答下列问题:
(1)铁在元素周期表中的位置为 。
(2)写出TiO2+水解的离子方程式: 。
加入过量铁粉的作用是:① ;② 。
(3)操作 Ⅰ的实验步骤为:___________________,过滤。
(4)副产品主要成分的化学式为 。
(5)写出TiO2转化成TiCl4的化学方程式: 。
(共8分)实验探究是体验知识的产生和形成过程的基本途径。下面是某同学完成的探究实验报告的一部分:
实验名称:卤素单质的氧化性强弱比较
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
| 实验步骤 |
实验结论 |
| ①氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
|
| ③KI溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
请回答:
(1)完成该实验需用到的实验仪器是 。
(2)CCl4在实验中所起的作用是 。
(3)该同学的实验设计不足之是 ,
改进的办是 。
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:__________与盐酸反应最剧烈,__________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:_______,________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。
(3)仪器A的名称为________,干燥管D的作用是_____________________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_________________________。
(5)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为 。
某同学设计了下图所示的装置,可比较HNO3、H2CO3、H2SiO3的酸性强弱,进而比较氮、碳、硅元素非金属性强弱。供选择的试剂:稀硝酸、稀硫酸、碳酸钙固体、碳酸钠固体、硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液
(1)仪器a的名称: 。
(2)锥形瓶中装有某可溶性正盐,a中所盛试剂为 。
(3)装置B所盛试剂是 ,其作用是 。
(4)装置C所盛试剂是 ,
C中反应的离子方程式是 。
(5)通过实验证明碳、氮、硅的非金属性由强到弱的顺序是 。
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:____与盐酸反应最快,相同条件下所得气体体积比是____________。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由 ____。
Ⅱ.利用下图装置可以验证非金属性的变化规律。
(3)仪器A的名称为 ,干燥管D的作用是_______________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:
装置B中的化学方程式_______________________ 。
装置C中的实验现象为____________________________。离子方程式为____________。
(5)若要证明非金属性:C>Si,则A中加 、B中加Na2CO3、C中加 ,观察到C中溶液的现象为_______________________________。
(14分,每空2分)某研究性学习小组设计一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了O元素的非金属性比S强的实验研究。回答下列问题:
(1)图中D装置在实验中的作用是_______________。
(2)从以下所给物质中选出甲同学设计的实验所用到物质,图中试剂A为_________
①HNO3溶液②稀盐酸③稀醋酸④稀盐酸
写出试管C中发生反应的离子方程式 ______________________________________。
(3)乙同学设计的实验所用到试剂A为_________;试剂B为_________;试剂C为__________。
C处的现象为浅黄色沉淀产生;写出C中发生反应的化学方程式为___________。
为了比较卤素单质的氧化性强弱,可在实验室先制取Cl2,并将Cl2依次通入NaBr溶液和淀粉KI溶液中。有如下图所示的仪器(橡胶塞均为双孔)及药品,试回答:
(1)若所制气体从左向右流向时,上述仪器接口的连接顺序为H接____、___接___、___接___。
(2)装置3的作用是_______________,反应的离子方程式为________________________。
(3)装置1中产生的现象是_________________,反应的化学方程式为_______________。
(4)通过本实验可得到的结论是____________________________________。
(8分)实验探究是体验知识的产生和形成过程的基本途径。下面是某同学完成的探究实验报告的一部分:
实验名称:卤素单质的氧化性强弱比较
| 实验步骤 |
实验结论 |
| ①氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
|
| ③KI溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
实验设计如下,请回答:
(1)完成该实验需用到的实验仪器是________、________。
(2)②中反应的化学方程式为________________。
③中反应的离子方程式为__________________。
(3)CCl4在实验中所起的作用是________。
(4)该同学的实验设计不足之处是___________________,改进的办法是____________。
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(1)装置A的分液漏斗中盛装的试剂是 ,烧瓶中加入的试剂是 。
(2)虚线框内的实验装置的作用 。
(3)装置B中盛放的试剂是 (选填下列所给试剂的代码),实验现象为 ,化学反应方程式是 ,该反应属于四种基本反应类型中的 反应。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例)。
某同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。

实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,…,关闭活塞a。
请回答:
(1)B中反应的离子方程式是__ ____。
(2)通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。
| A.挥发性 | B.还原性 | C.氧化性 | D.酸性 |
(3)C装置的作用是________,X是________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是______ __,
D中反应的化学方程式是_____ ___。
(5)碳、硅的非金属性逐渐减弱的原因是________(从原子结构角度加以解释)。
根据要求完成下列实验过程(a、b为弹簧夹,加热及固定装置已略去)。
(1)验证SO2的氧化性、还原性和酸性氧化物的通性。
①连接仪器、_______________、加药品后,打开a、关闭b,然后滴入浓硫酸。
②装置A中发生的化学方程式是_______________。
③验证SO2的氧化性的实验现象是_______________。
④BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。写出其中SO2显示还原性生成沉淀的离子方程式:_________。
(2)验证碳、硅非金属性的相对强弱。
①在(1)①操作后打开b,关闭a。
②NaHCO3饱和溶液中发生的离子反应方程式为_______________。
③实验过程中,C中出现白色沉淀。甲同学认为不能由此说明碳的非金属性比硅强,需增加一个实验装置才能获得可靠实验结论,其改进方法为_______________。
某研究性学习小组设计了一组实验验证元素周期律。
(1)甲同学在a、b、c三只烧杯里分别加入50 mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象。
①甲同学设计实验的目的是________________________________________________;
②反应最剧烈的烧杯是_______(填字母);
③写出b烧杯里发生反应的离子方程式______ _____ __。
(2)乙同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强。他设计了下图装置以验证碳、氮、硅元素的非金属性强弱。
乙同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成。
①写出所选用物质的化学式:A、________; B、________;C、________。
②写出烧瓶中发生反应的化学方程式:
___________________________________________________________。
③写出烧杯中发生反应的化学方程式:
___________________________________________________________。
④碳、氮、硅元素的非金属性强弱顺序为_______________________。
某学生做元素性质递变实验时自己设计了一套方案,并记录了有关实验现象如下表(实验方案与实验现象没对应)
| 实验方案 |
| 1.用砂纸打磨后的镁带加适量水加热,再向反应后溶液中滴加酚酞 |
| 2.钠与滴有酚酞试液的冷水反应 |
| 3.镁带与2mol/L的盐酸反应 |
| 4.铝条与2mol/L的盐酸反应 |
| 5.向氯化铝溶液中滴加氢氧化钠溶液至过量 |
| 实验现象 |
| (A) |
| (B)反应不十分强烈,产生气体 |
| (C)剧烈反应,产生气体 |
| (D)生成白色胶状沉淀,然后沉淀消失 |
| (E)产生的气体可在空气中燃烧,溶液变成浅红色 |
请你帮助该同学完成实验报告:
(1)实验的目的 。
(2)实验仪器:① ② ③ ④试管夹
⑤镊子⑥小刀⑦玻璃片⑧砂纸等
(3)实验内容:
与实验方案1至5对应的实验现象依次为 (填字母编号)。实验现象
(A)为: 。
(4)实验结论 。
实验探究:探究碳、硅元素的非金属性的相对强弱
根据要求完成下列各小题
(1)实验装置:
填写所示仪器名称A B
(2)实验步骤:
连接仪器、_____________、加药品后,打开a、然后滴入浓硫酸,加热
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是 ;
装置E中足量酸性KMnO4溶液的作用是 ;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是 ;
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性___(填“能”或“否”),试管D中发生反应的离子方程式是
某化学兴趣小组进行实验探究:探究碳、硅元素的非金属性的相对强弱。根据要求回答下列问题:
(1)实验装置: 
填写所示仪器名称A 。
(2)实验步骤:
连接仪器、_____________、加药品后,打开a、然后滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是 。
装置E中足量酸性KMnO4溶液的作用是 。
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是 。
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性____。(填“能”或“否”),原因是 。