某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:____与盐酸反应最快,相同条件下所得气体体积比是____________。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由 ____。
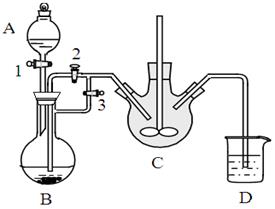
Ⅱ.利用下图装置可以验证非金属性的变化规律。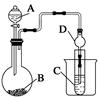
(3)仪器A的名称为 ,干燥管D的作用是_______________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:
装置B中的化学方程式_______________________ 。
装置C中的实验现象为____________________________。离子方程式为____________。
(5)若要证明非金属性:C>Si,则A中加 、B中加Na2CO3、C中加 ,观察到C中溶液的现象为_______________________________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号