A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大。已知:A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍。下列说法正确的是
A.原子半径的大小顺序:r(B)>r(C)>r(D)
B.B的简单气态氢化物的热稳定性比D的弱
C.E分别与A、C形成的化合物中化学键类型相同
D.C的最高价氧化物对应水化物的碱性在同周期中最强
第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.010 mol·L-1的这四种溶液pH与该元素原子半径的关系如图所示。下列说法正确的是
| A.简单离子半径:X>Y>Z>W |
| B.Y元素存在同素异形体 |
| C.气态氢化物的稳定性:Z>W>Y |
| D.X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性 |
已知X、Y、Z、R、W是原子序数依次增大的五种短周期主族元素,其中只有Z是金属元素,Y是地壳中含量最高的元素,X、Y、R在周期表中的相对位置关系如下图。
下列说法正确的是
| A.五种元素中原子半径最大的是W,离子半径最大的是R离子 |
| B.X、R、W三种元素的最高价氧化物所对应的水化物的酸性强弱关系为R>W>X |
| C.Y与Z形成的化合物一定是碱性氧化物 |
| D.Z与W形成的化合物水溶液可能显酸性 |
短周期元素R、X、Y、Z原子序数依次增大,其中R的气态氢化物的水溶液呈碱性,X是同周期中原子半径最大的元素,Y的单质是一种常见的半导体材料,Y与Z的原子序数相差3,下列判断正确的是
| A.最外层电子数:Z>R>Y |
| B.气态氢化物的稳定性:Y>Z |
| C.R、X的氧化物均为离子化合物 |
| D.X和Y两者最高价氧化物对应的水化物能相互反应 |
短周期元素W、X、Y和Z的原子序数依次增大。金属W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y的单质是常见的金属,可做海洋电池的负极材料。Z原子的质子数是同主族上一周期原子质子数的2倍。下列说法正确的是
| A.由金属W制备的高效电池可用NH4Cl溶液作电解质 |
| B.元素X与氢形成的化合物中不可能既有极性健又有非极性健 |
| C.元素Y、Z分别形成的简单离子,后者的离子半径较前者大 |
| D.元素Y、Z的最高价氧化物对应的水化物之间不能反应 |
原子序数依次递增的 4 种短周期元素可形成简单离子W2-、X+、Y3+、Z2-,下列说法不正确的是
| A.工业上常采用电解法冶炼Y 单质 |
| B.气态氢化物的稳定性:H2W强于H2Z |
| C.离子半径由大到小:Z2->X+>Y3+>W2- |
| D.W、X 形成的化合物中阴、阳离子个数比一定是1:2 |
(13分)A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性。它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题: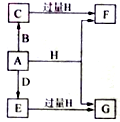
(1)A所含元素在周期表中的位置为 ,C的电子式为 。
(2)A与H在加热条件下反应的化学方程式为 。
(3)25℃时,pH均为10的H和G溶液,由水电离出的c(OH-)之比为 。
(4)将A溶于沸腾的G溶液中可以制得化合物I,I在酸性溶液中不稳定,易生成等物质的量的A和E,I在酸性条件下生成A和E的离子方程式为 。I是中强还原剂,在纺织、造纸工业中作为脱氯剂,向I溶液中通入氯气可发生反应,参加反应的I和氯气的物质的量比为1:4,该反应的离子方程式为 。
(5)向含有0.4mol F、0.1 mol G的混合溶液中加入过量盐酸,完全反应后收集到a L气体C(标准状况),取反应后澄清溶液,加入过量FeCl3溶液,得到沉淀3.2g,则a= 。
四种短周期元素X、Y、Z、W的原子序数依次增大,X的最外层电子数是次外层电子数的2倍,Y、W同主族且能形成两种常见的化合物,X、W质子数之和是Z质子数的2倍。则下列说法中正确 的是
| A.原子半径比较:X<Y<Z<W |
| B.X的氢化物沸点一定低于Y的氢化物 |
| C.Y的氢化物稳定性一定弱于W的氢化物 |
| D.短周期所有元素中,Z的最高价氧化物的水化物碱性最强 |
X、Y、Z、W、M是元素周期表中原子序数依次增大的五种元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
元素周期表中核电荷数最小的元素 |
| Y |
Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质 |
| Z |
Z是大气中含量多的元素,其某些氧化物为大气中常见的污染物 |
| W |
W是地壳中含量最高的金属元素 |
| M |
常见金属,单质呈紫红色 |
(1)W位于元素周期表第 周期第 族;W的简单离子半径比Z的简单离子半径 (填“大”或“小”)。
(2)Z原子的第一电离能比氧原子的 (填“大”或“小”);M的基态原子价电子排布式是
(3)X与Y可形成多种化合物,其中常用来切割或焊接金属的气体分子中σ键和π键之比是 ,空间构型是
(4)X与Z形成的最简单化合物用途非常广泛,试列举两种用途: 、 ;该化合物具有较强的还原性,加热时能将M的氧化物MO还原,写出该反应的化学方程式:____。
(5)可用YX4还原ZOx以消除其污染。已知:
YX4 (g) +4ZO2 (g)=4ZO(g)+YO2(g)+2X2O(g) △H=" -" 574 kJ·mol-1
YX4 (g)+4ZO(g)=2Z2 (g)十YO2 (g) +2X2O(g) △H =" -" 1160 kJ·mol-1
试写出用YX4还原ZO2至Z2的热化学方程式:____。
(共8分)实验探究是体验知识的产生和形成过程的基本途径。下面是某同学完成的探究实验报告的一部分:
实验名称:卤素单质的氧化性强弱比较
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
| 实验步骤 |
实验结论 |
| ①氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
|
| ③KI溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
请回答:
(1)完成该实验需用到的实验仪器是 。
(2)CCl4在实验中所起的作用是 。
(3)该同学的实验设计不足之是 ,
改进的办是 。
(14分) A、B、C、D、E是原子序数依次增大的短周期主族元素,A、D在周期表中的相对位置如下表;A元素最低负化合价的绝对值与其原子最外层电子数相等;C是地壳中含量最多的金属元素。
| |
A |
|
|
|
| |
|
|
D |
|
(1)A与氢元素组成的化合物分子有6个原子,其结构简式为_____________,写出该化合物在常温下使溴水褪色的化学方程式______________________________,该化合物还是一种重要的化工原料,写出其加聚生成高分子的化学方程式:____________________________。
(2)B元素的最高氧化物对应的水化物与它的氢化物反应得到离子化合物,则B元素的单质分子空间构型为___________,写出该单质的一种等电子体:_________________。
(3)C的离子结构示意图为____________,元素E在周期表中的位置是_________________。
若某基态原子的外围电子排布为4d15s2,则下列说法正确的是
| A.该元素基态原子中共有3个电子 | B.该元素原子核外有5个电子层 |
| C.该元素原子最外层共有3个电子 | D.该元素原子M能层共有8个电子 |
A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C 处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答:
(1)C在元素周期表的第 周期 族。
(2)五种元素中,形成最简单的非金属氢化物的稳定性由大到小的顺序是(用分子表示) 。
(3)B、D形成的原子个数比为1∶1的化合物的电子式是 。
(4)E的一种氢化物叫肼,其分子中E原子与氢原子个数比为1 :2,肼的电子式 。肼—空气燃料电池是一种环保碱性燃料电池,其电解质溶液是20%—30%的KOH溶液。该燃料电池的正极的电极反应式是____________。
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:__________与盐酸反应最剧烈,__________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:_______,________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。
(3)仪器A的名称为________,干燥管D的作用是_____________________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_________________________。
(5)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为 。
A、B、C是三种短周期元素,其中A元素原子M层上电子数比L层少2个电子;B元素原子比A元素原子的电子层少,又知B元素最高正价与负化合价的绝对值相等;C 元素的阳离子核外电子排布与Ne原子核外电子排布相同;且又知这三种元素可组成BA2型共价化合物和C2A型离子化合物。由上述条件回答下列问题:
(1)A、B、C三元素的名称分别是:A_______,B_______,C_______。
(2)化合物C2A的电子式是______________,BA2的结构式是:_______________。
(3)A、C的最高价氧化物对应的水化物之间的离子反应方程式为 。