广东省广州市高三综合测试(二)理综化学试卷
下列说法正确的是
| A.青铜、碳素钢和石英都是合金 |
| B.陶瓷、玻璃和水泥都是无机非金属材料 |
| C.乙醇与乙醛互为同分异构体,都能发生银镜反应 |
| D.油脂皂化和蛋白质水解都是由高分子生成小分子的过程 |
合成二甲醚的三步反应如下:
2H2(g) + CO(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
2CH3OH (g) CH3OCH3 (g) + H2O(g) ΔH2
CH3OCH3 (g) + H2O(g) ΔH2
CO(g) + H2O (g) CO2(g) + H2(g) ΔH3
CO2(g) + H2(g) ΔH3
则 3H2(g) + 3CO(g) CH3OCH3(g) + CO2(g) 的ΔH是
CH3OCH3(g) + CO2(g) 的ΔH是
| A.ΔH=2ΔH1+ΔH2+ΔH3 | B.ΔH=ΔH1+ΔH2+ΔH3 |
| C.ΔH=ΔH1+2ΔH2+2ΔH3 | D.ΔH=2ΔH1+ΔH2—ΔH3 |
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 |
叙述Ⅰ |
叙述Ⅱ |
| A |
Fe3+有氧化性 |
Fe 2(SO4)3可作净水剂 |
| B |
浓硫酸有腐蚀性 |
常温下浓硫酸不能用铁罐盛装 |
| C |
Cl2是非金属单质 |
Cl2能使湿润的有色布条褪色 |
| D |
熔融状态的Al2O3中有自由移动的Al3+和O2- |
电解熔融状态的Al2O3制备Al |
常温下,浓度均为0.1 mol·L-1的下列溶液中,粒子的物质的量浓度关系正确的是
| A.氨水中,c(NH4+)=c(OH-)="0.1" mol·L-1 |
| B.NH4Cl溶液中,c(NH4+)>c(Cl-) |
| C.Na2SO4溶液中,c(Na +)>c(SO42-)>c(OH-)= c(H+) |
| D.Na2SO3溶液中,c(Na +)= 2c(SO32-)+ c(HSO3-) + c(H2SO3) |
设nA为阿伏加德罗常数的数值,下列说法正确的是
| A.0.1 mol·L-1Ba(OH)2溶液中含有0.2nA个OH- |
| B.1mol Na与足量水反应,转移2nA个电子 |
| C.常温常压下,22.4L乙烯含有nA个CH2=CH2分子 |
| D.常温常压下,46g NO2含有2nA个氧原子 |
某小组为研究原电池原理,设计如图装置,下列叙述正确的是
| A.若X为Fe,Y为Cu,铁为正极 |
| B.若X为Fe,Y为Cu,电子由铜片流向铁片 |
| C.若X为Fe,Y为C,碳棒上有红色固体析出 |
| D.若X为Cu,Y为Zn,锌片发生还原反应 |
下列实验操作、现象和结论均正确的是
| 选项 |
操作 |
现象 |
结论 |
| A |
向FeSO4溶液中滴入少量酸性KMnO4溶液 |
KMnO4溶液紫色褪去 |
Fe2+有氧化性 |
| B |
向Na2SiO3溶液中通入适量的CO2 |
产生白色胶状物质 |
酸性:H2CO3>H2SiO3 |
| C |
将新制氯水和NaBr溶液在试管中混合后,加入CCl4,振荡,静置 |
下层溶液呈橙红色 |
氧化性:Cl2>Br2 |
| D |
向Al2(SO4)3溶液中滴加过量氨水 |
溶液先浑浊后澄清 |
Al3+与NH3·H2O不能大量共存 |
短周期元素R、X、Y、Z原子序数依次增大,其中R的气态氢化物的水溶液呈碱性,X是同周期中原子半径最大的元素,Y的单质是一种常见的半导体材料,Y与Z的原子序数相差3,下列判断正确的是
| A.最外层电子数:Z>R>Y |
| B.气态氢化物的稳定性:Y>Z |
| C.R、X的氧化物均为离子化合物 |
| D.X和Y两者最高价氧化物对应的水化物能相互反应 |
席夫碱类化合物在催化、药物等方面用途广泛。某种席夫碱的合成路线①如下:
(1)Ⅰ的分子式为________.1 mol Ⅴ完全燃烧至少需要消耗________mol O2。
(2)Ⅲ与NaOH水溶液共热反应,化学方程式为________。
(3)Ⅳ发生聚合反应生成的高分子化合物的结构简式为________。
(4)Ⅰ的一种同分异构体Ⅵ在酸性条件下发生水解,生成物之一遇FeCl3溶液显紫色,Ⅵ的核磁共振氢谱除苯环峰外还有两组峰,峰面积之比为3︰2,Ⅵ的结构简式为________(写出一种)。
(5)结合合成路线①,分析以下合成路线②:
X的结构简式为________,Z的结构简式为________。
已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应
Ⅰ:WO42-(aq) + Ca(OH)2(s)  CaWO4(s) + 2OH-(aq)。
CaWO4(s) + 2OH-(aq)。
(1)下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。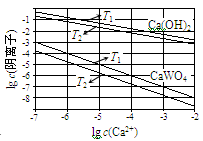
①计算T1时KSP(CaWO4)= ________。
②T1________ T2(填“>”“=”或“<”)。
(2)反应Ⅰ的平衡常数K理论值如下表:
| 温度/℃ |
25 |
50 |
90 |
100 |
| K |
79.96 |
208.06 |
222.88 |
258.05 |
①该反应平衡常数K的表达式为________。
②该反应的△H________0(填“>”“=”或“<”)。
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4) =" c(NaOH)" =" 0.5" mol·L-1]中,加入过量Ca(OH)2,反应达到平衡后WO42—的沉淀率为60%,计算实验测得的平衡常数。
(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,分析其作用:________。
回收利用炼铜工业产生的排放物,既能节约资源,又能保护环境。
(1)用氨水吸收尾气中的SO2后,再加入硫酸,可获得SO2
和(NH4)2SO4两种产品。相关反应的化学方程式为________、________。
(2)烟灰中金属元素以硫酸盐和氧化物形态存在,其中锌、铅的含量最大,其次为铜、铁等。烟灰的回收利用工艺如下:
①“沉铜”可得到单质铜,该步骤应加入的试剂是________。
②“一次浸取”铜浸出率较低,原因是烟灰中部分铜元素以________(填化学式)残留在浸出渣中,“二次浸取”应选择_________(填化学式)作浸取剂。
(3)从贵金属阳极泥中可提取粗银。电解法精炼粗银时采用AgNO3和HNO3的混合液作电解液,阴极的主要电极反应式为________。阴极还有少量副反应发生,产生的气体遇空气迅速变为红棕色,该副反应的电极反应式为________。
某小组以醋酸为例探究弱酸的性质。
(1)实验一:探究酸的强弱对酸与镁条反应速率的影响。
①设计实验方案如下表,表中c =________mol·L-1。
| 编号 |
酸的种类 |
酸的浓度/mol·L-1 |
酸的体积/mL |
镁条质量/g |
| 1 |
醋酸 |
1.0 |
10 |
2.0 |
| 2 |
盐酸 |
c |
10 |
2.0 |
②实验步骤:a)检查装置(如图)的气密性后,添加药品;
b)反应开始后,________;
c)将所记录的数据转化为曲线图(下图).
③写出0~5min醋酸、盐酸与镁条反应的反应速率变化规律:________。
(2)实验二:现有一瓶醋酸溶液,常温下测定其中醋酸的电离程度(已电离的电解质分子数占原来总分子数的百分比)。设计实验方案,将待测物理量和对应的测定方法填写在下表中。
| 待测物理量 |
测定方法 |
| ①__________ |
量取25.00ml醋酸溶液于锥形瓶中,滴加指示剂,将0.1000mol·L-1 NaOH标准溶液装入________,滴定至终点,记录数据.重复滴定2次. |
| ②__________ |
__________ |
 粤公网安备 44130202000953号
粤公网安备 44130202000953号