北京市东城区高三二模理综化学试卷
化学与生活、社会密切相关。下列说法不正确的是
| A.维生素C可用于治疗胃酸过多 |
| B.加入Na2S可消除污水中的污染Hg2+ |
| C.利用太阳能等清洁能源有利于保护环境 |
| D.开发废电池的综合利用技术有利于防止污染土壤 |
下列叙述正确的是
| A.硅酸、氯化铁均为胶体 | B.醋酸、蔗糖均属于电解质 |
| C.水玻璃、氯水均为混合物 | D.氧化钙、氧化铝均为碱性氧化物 |
下列各组粒子能在指定溶液中大量共存的是(
| A.银氨溶液中:Na+、H+、NO3- | B.碘化钾溶液中:H+、H2O2、SO32- |
| C.偏铝酸钠溶液中:K+、Cl-、SO42- | D.氢氧化钙溶液中:Na+、ClO-、HCO3- |
下列说法正确的是
| A.以铜作阴极、铁作阳极、硫酸铜为电解液可完成铁上镀铜 |
| B.水的电离是吸热过程,升高温度,水的离子积增大、减小pH |
C.由反应2C+SiO2 Si+2CO,可得出C的非金属性强于Si Si+2CO,可得出C的非金属性强于Si |
| D.pH=9的醋酸钠溶液和pH=9的氨水中水的电离程度相同 |
关于下列各装置的叙述不正确的是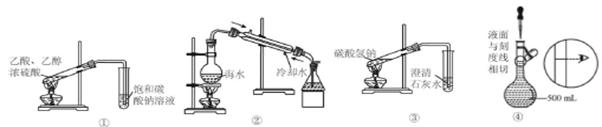
| A.装置①可用于制备乙酸乙酯 | B.装置②可用于模拟海水蒸馏 |
| C.装置③可用于探究碳酸氢钠的热稳定性 | D.装置④为配制溶液过程中的定容操作 |
原子序数依次递增的 4 种短周期元素可形成简单离子W2-、X+、Y3+、Z2-,下列说法不正确的是
| A.工业上常采用电解法冶炼Y 单质 |
| B.气态氢化物的稳定性:H2W强于H2Z |
| C.离子半径由大到小:Z2->X+>Y3+>W2- |
| D.W、X 形成的化合物中阴、阳离子个数比一定是1:2 |
PX是一种重要的化工原料。PX属于烃类,以其为原料合成高分子树脂E和P的路线如下
回答下列问题:
(1)B中官能团名称是 。
(2)F的结构简式是 。
(3)M →N的反应类型是 。
(4)PX→G的化学方程式是 。
(5)D可发生缩聚反应生成E,其化学方程式是 。
(6)M的同分异构体中,苯环上一氯代物只有一种的有______种,写出其中任意一种同分异构体的结构简式 __________。
氨在国防、工农业等领域发挥着重要作用。
(1)工业以甲烷为原料生产氨气的过程如下:
①过程Ⅰ中,有关化学反应的能量变化如下图所示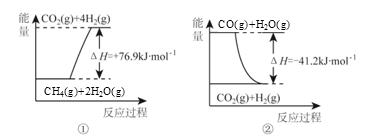
反应①为 反应(填“吸热”或“放热”),CH4 (g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式是 。
②CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ)溶液吸收,其反应原理为: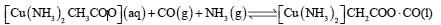 ,所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是 。(选填字母)。
,所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是 。(选填字母)。
a.高温、高压 b.高温、低压
c.低温、低压 d.低温、高压
③下表是过程Ⅱ中,反应物的量相同时,不同条件下平衡体系中氨的体积分数
Ⅰ.根据表中数据,得出的结论是 。
Ⅱ.恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n(N2)= 0.1mol,
n(H2)= 0.3mol。下列图象能正确表示该过程中相关量的变化的是 。(选填字母)。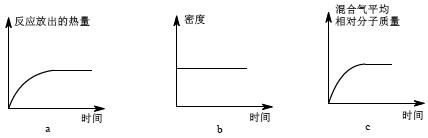
(2)直接供氨式固体氧化物燃料电池能量转化率达85%,其结构示意图如图所示:
①负极的电极反应式是______。
②用该电池电解300ml的饱和食盐水。一段时间后,溶液pH=13(忽略溶液体积的变化),则消耗NH3溶液的体积是_____L。(标准状况)
碱式硫酸铁[Fe(OH)SO4]可用作净水剂、媒染剂、颜料和药物。工业上利用废铁屑(含少量氧化铝、氧化铁等),生产碱式硫酸铁的部分工艺如下: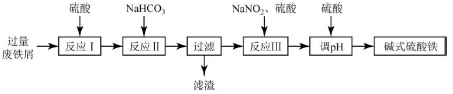
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表: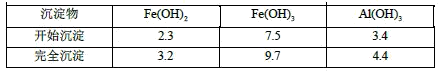
(1)反应I中发生的氧化还原反应的离子方程式是__________。
(2)反应II中加入NaHCO3调节体系的pH在____范围内。
(3)反应III中生成的气体遇空气变红棕色,则III中发生反应的离子方程式是_________ 。
(4)反应III中通入氧气可减少NaNO2的用量,若消耗1mol氧气可节约n(NaNO2)=____mol。
(5)用硫酸可知体系的pH。若硫酸加入量过小,溶液生成沉淀;若硫酸加入量过大,不利于产品形成,用化学平衡移动原理分析其原因是_________。
(6)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可发生水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式是____________。
某学习小组设计实验,探究二氧化硫的漂白性和还原性。
(1)漂白性
甲同学用如图所示装置(气密性良好)进行实验,观察到如下现象:Ⅰ中红色褪去,Ⅱ中无变化。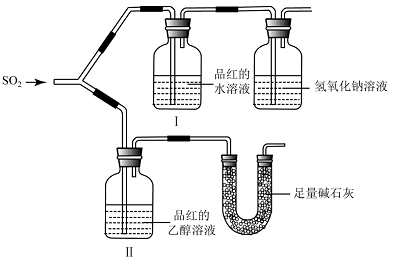
①甲同学作对照实验的目的是 。
②足量碱石灰的作用是 。
甲同学由此得出的实验结论是 。
(2)还原性:
乙同学将SO2通入FeCl3溶液中,使其充分反应。
①SO2与FeCl3反应的离子方程式是 ,检验该反应所得含氧酸根离子的方法是 。
②实验中观察到溶液由黄色变为红棕色,静置一段时间,变为浅绿色。资料显示:红棕色为FeSO3 (墨绿色难溶物)与FeCl3溶液形成的混合色。 则②中红棕色变为浅绿色的原因是 。
乙同学得出的实验结论是:二氧化硫可还原三氯化铁。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号